W miarę jak globalne zapotrzebowanie na zrównoważone i opłacalne rozwiązania do magazynowania energii rośnie, baterie sodowo-jonowe (Na-ion) stają się atrakcyjną alternatywą dla tradycyjnych technologii litowo-jonowych (Li-ion). Dzięki obfitości surowców, mniejszemu wpływowi na środowisko oraz obiecującym właściwościom elektrochemicznym, akumulatory Na-ion szybko zyskują na znaczeniu w zastosowaniach od magazynowania energii na skalę sieciową po pojazdy elektryczne i elektronikę użytkową. W centrum tej innowacji leży podstawowy proces elektrochemiczny: odwracalny ruch jonów sodu między katodą a anodą podczas ładowania i rozładowywania. W tym artykule przyjrzymy się skomplikowanym mechanizmom rządzącym cyklami ładowania i rozładowywania baterii sodowo-jonowych, rzutując światło na to, dlaczego ta technologia jest gotowa odmienić przyszłość magazynowania energii.
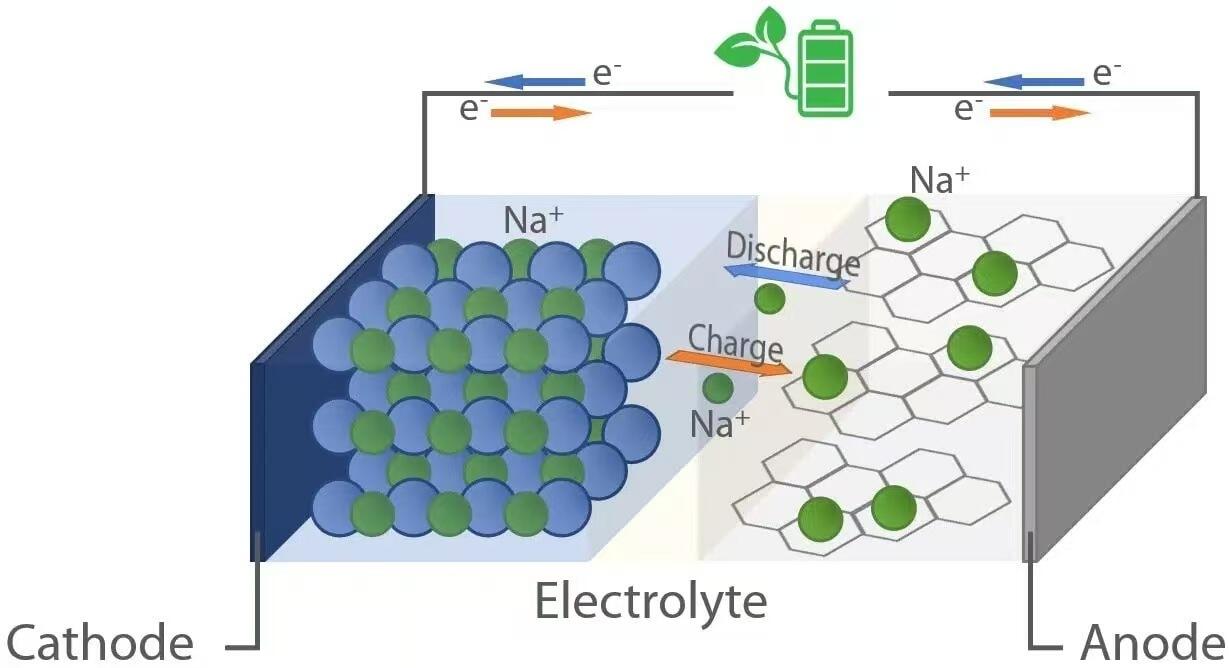
Tak jak ich odpowiedniki litowo-jonowe, baterie sodowo-jonowe działają na zasadzie elektrochemii typu „rocking-chair”. Podczas rozładowania — gdy bateria zasila urządzenie — jony sodu (Na⁺) migrują z anody (elektrody ujemnej) przez elektrolit do katody (elektrody dodatniej). Jednocześnie elektrony przepływają przez obwód zewnętrzny, dostarczając energię elektryczną do podłączonego odbiornika. Z kolei podczas ładowania zewnętrzne źródło energii powoduje przemieszczenie jonów sodu z powrotem z katody do anody, gromadząc energię na przyszłe wykorzystanie. Ten odwracalny ruch jonów jest możliwy dzięki materiałom nośnikowym w obu elektrodach, które mogą odwracalnie interkalcjonować (wstawiać) i deinterkalcjonować (usunąć) jony sodu bez znaczącego pogorszenia struktury.
Gdy bateria sodowo-jonowa się rozładowuje, utlenianie zachodzi na anodzie. Do typowych materiałów anodowych zalicza się węgiel drzewny, który posiada nieuporządkowaną strukturę z nanoporami zdolnymi do przechwytywania jonów Na⁺. Gdy bateria dostarcza energię, atomy sodu w anodzie uwalniają elektrony (e⁻) i stają się jonami Na⁺:
Anoda (Utlenianie):
Na → Na⁺ + e⁻
Elektrony te przepływają przez obwód zewnętrzny, zasilając urządzenia, podczas gdy jony Na⁺ przemieszczają się przez ciekły lub stały elektrolit w kierunku katody. W katodzie—zazwyczaj zbudowanej z warstwowych tlenków metali przejściowych (np. NaₓMO₂, gdzie M = Mn, Fe, Ni itp.), związków polianionowych lub analogów niebieskiego bavarskiego—zachodzi redukcja, ponieważ jony Na⁺ oraz napływające elektrony są wbudowywane do sieci krystalicznej:
Katoda (Redukcja):
Na⁺ + e⁻ + Nośnik → Na–Nośnik
To wtrącenie stabilizuje strukturę katody i zamyka obwód elektrochemiczny. Napięcie generowane podczas rozładowania zależy od różnicy potencjału elektrochemicznego między materiałami anody i katody, zwykle zawiera się w zakresie od 2,5 do 3,7 V dla komercyjnych ogniw Na-ion.
Podczas ładowania do ogniwka przykłada się napięcie zewnętrzne większe niż jego napięcie no-load (stanu jałowego), co powoduje odwrócenie reakcji elektrochemicznych. Jony sodu są usuwane z katody poprzez utlenianie:
Katoda (utlenianie):
Na–Nośnik → Na⁺ + e⁻ + Nośnik
Uwalniane jony Na⁺ przemieszczają się przez elektrolit z powrotem do anody, podczas gdy elektrony wracają przez zewnętrzne źródło zasilania. Na anodzie zachodzi redukcja, gdy jony Na⁺ łączą się z elektronami i ponownie interkalują do matrycy węglowej:
Anoda (redukcja):
Na⁺ + e⁻ → Na (interkalowany)
Ten proces przywraca energię zgromadzoną w baterii, przygotowując ją do następnego cyklu rozładowania. Skuteczna wymiana ładunku, minimalne reakcje uboczne oraz stabilność strukturalna materiałów elektrod są kluczowe dla osiągnięcia długiej trwałości cyklicznej i wysokiej sprawności coulombowskiej — kluczowych parametrów określających opłacalność komercyjną.
Elektrolit — zazwyczaj sól sodowa (np. NaClO₄ lub NaPF₆) rozpuszczona w organicznych rozpuszczalnikach węglanowych — odgrywa kluczową rolę w zapewnianiu szybkiego transportu jonów przy jednoczesnym zachowaniu stabilności elektrochemicznej. Podczas początkowych cykli ładowania na powierzchni anody tworzy się warstwa międzymetaliczna stały-elektrolit (SEI). Ta warstwa pasywacyjna zapobiega dalszemu rozkładowi elektrolitu, umożliwiając jednocześnie przepływ jonów Na⁺ — delikatna równowaga niezbędna dla bezpieczeństwa i długowieczności.
Naturalne występowanie sodu (ponad 1000 razy bardziej powszechne niż lit w skorupie ziemskiej) przekłada się na niższe koszty materiałów i zmniejszone ryzyko geopolitycznych zagrożeń dostaw. Dodatkowo, w bateriach typu Na-jon można stosować aluminium jako kolektor prądu dla anody (w przeciwieństwie do Li-jon, które wymaga miedzi), co dalszych obniża koszty i wagę. Jednak jony sodu są większe i cięższe niż jony litu, co powoduje nieco niższą gęstość energii oraz wolniejsze kinetyki dyfuzji. Trwające badania koncentrują się na opracowywaniu zaawansowanych architektur elektrod, materiałów nanostrukturalnych oraz elektrolitów stałych, aby pokonać te ograniczenia.
Mechanizmy ładowania i rozładowania baterii sodowych stanowią przykład eleganckiej synergii między nauką o materiałach a elektrochemią, tworząc solidne podstawy dla nowej generacji magazynowania energii. W przeciwieństwie do swoich litowo-jonowych odpowiedników, oparcie się na obfitym i tanim sodzie nie tylko minimalizuje ryzyka związane z łańcuchem dostaw, ale także jest zgodne z globalnymi celami zrównoważonego rozwoju. W miarę jak badacze ciągle doskonalą skład elektrod—poprawiając stabilność i gęstość energii—optymalizują skład elektrolitu w celu zwiększenia trwałości i bezpieczeństwa oraz rozwijają procesy produkcji na dużą skalę, aby obniżyć koszty wytwarzania, technologia baterii sodowych stopniowo pokonuje pozostałe bariery techniczne. Ten postęp pozwala bateriom Na-ion odegrać przełomową rolę w dekarbonizacji systemów energetycznych na całym świecie, począwszy od magazynów energii na skalę sieciową wspierających integrację źródeł odnawialnych, przez przenośne zasilanie, aż po niskoprędkościowe pojazdy elektryczne. Wykorzystując prosty, lecz potężny ruch jonów sodu, nie tylko efektywnie i niedrogim kosztem magazynujemy energię elektryczną—kształtujemy również bardziej dostępne, odporne i zrównoważone przyszłość energetyczną. Łączy ona innowacje technologiczne z ich rzeczywistym zastosowaniem, oferując realną ścieżkę redukcji emisji dwutlenku węgla i budowy bardziej ekologicznego globalnego systemu energetycznego.