با افزایش تقاضای جهانی برای راهکارهای ذخیرهسازی انرژی پایدار و مقرونبهصرفه، باتریهای سدیم-یون (Na-ion) به عنوان گزینهای جذاب در مقابل فناوریهای سنتی لیتیوم-یون (Li-ion) ظهور کردهاند. با توجه به مواد اولیه فراوان، تأثیر زیستمحیطی کمتر و عملکرد الکتروشیمیایی امیدوارکننده، باتریهای سدیم-یون به سرعت در کاربردهای متنوعی از ذخیرهسازی انرژی در شبکه تا خودروهای برقی و الکترونیک مصرفی محبوبیت پیدا کردهاند. در مرکز این نوآوری، فرآیند الکتروشیمیایی اساسی قرار دارد: حرکت برگشتپذیر یونهای سدیم بین کاتد و آند در حین شارژ و دشارژ کردن. در این مقاله، مکانیسمهای پیچیدهای که چرخههای شارژ و دشارژ باتریهای سدیم-یون را کنترل میکنند، بررسی میشوند و دلایل اینکه چرا این فناوری در آستانه تغییر چهره آینده ذخیرهسازی انرژی قرار دارد، روشن میشود.
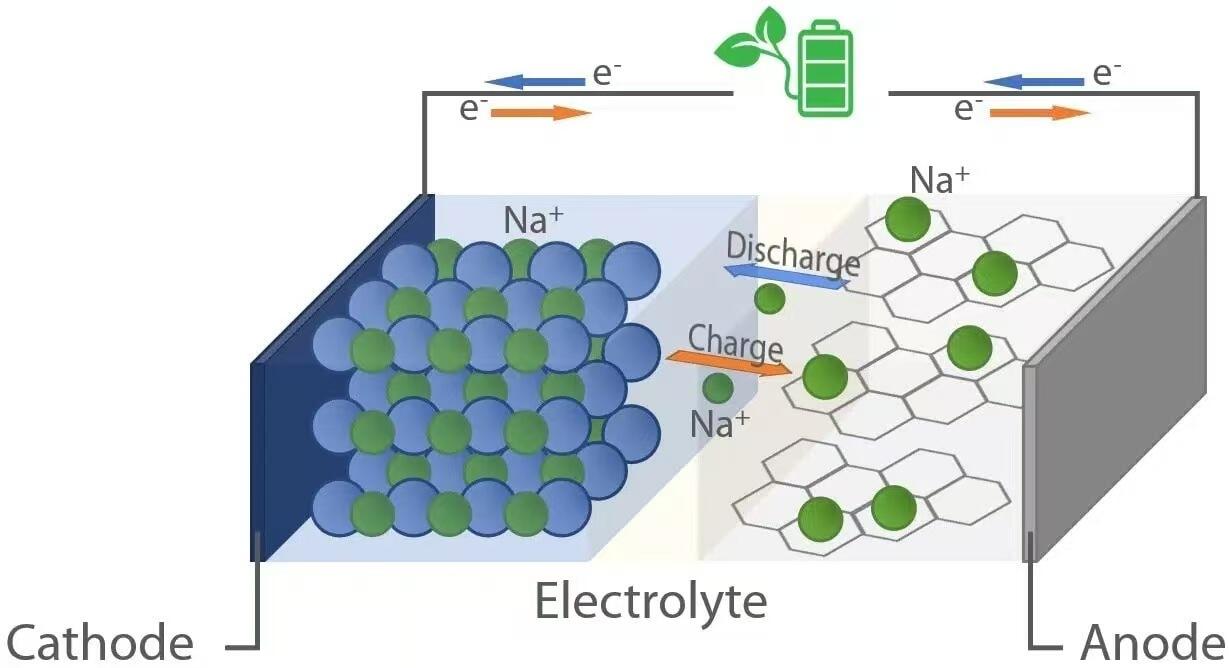
همانطور که باتریهای یون لیتیوم، باتریهای یون سدیم نیز بر اساس اصل الکتروشیمی «تختخواب تابآور» (rocking-chair) عمل میکنند. در حین تخلیه — زمانی که باتری دستگاهی را تغذیه میکند — یونهای سدیم (Na⁺) از آند (الکترود منفی) از طریق الکترولیت به کاتد (الکترود مثبت) مهاجرت میکنند. همزمان، الکترونها از طریق مدار خارجی جریان یافته و انرژی الکتریکی را به بار متصل شده تحویل میدهند. در مقابل، در حین شارژ، یک منبع تغذیه خارجی یونهای سدیم را از کاتد به آند بازمیگرداند و انرژی را برای استفاده آینده ذخیره میکند. این حرکت رفتوبرگشتی یونها توسط مواد میزبان در هر دو الکترود تسهیل میشود که قادر به درج معکوس (اینتروکالاسیون) و خارجکردن معکوس (دی-اینتروکالاسیون) یونهای سدیم بدون تخریب قابل توجه ساختاری هستند.
هنگامی که یک باتری یون سدیم تخلیه میشود، اکسیداسیون در آند رخ میدهد. مواد متداول آند شامل کربن سخت است که دارای ساختار نامنظم با حفرههای نانومتری است و قادر به جای دادن یونهای Na⁺ است. هنگامی که باتری انرژی تأمین میکند، اتمهای سدیم درون آند الکترون (e⁻) آزاد میکنند و به یونهای Na⁺ تبدیل میشوند:
آند (اکسیداسیون):
Na → Na⁺ + e⁻
این الکترونها از طریق مدار خارجی حرکت کرده و دستگاهها را تغذیه میکنند، در حالی که یونهای Na⁺ از طریق الکترولیت مایع یا جامد به سمت کاتد حرکت میکنند. در کاتد — که معمولاً از اکسیدهای لایهای فلزات گذار (مانند NaₓMO₂، که M = Mn، Fe، Ni و غیره)، ترکیبات پلیآنیونی یا ترکیبات مشابه آبی پروسی تشکیل شده است — عمل کاهش رخ میدهد، زیرا یونهای Na⁺ و الکترونهای ورودی در شبکه بلوری گنجانده میشوند:
کاتد (کاهش):
Na⁺ + e⁻ + Host → Na–Host
این درج، ساختار کاتد را پایدار میکند و مدار الکتروشیمیایی را کامل میسازد. ولتاژ تولید شده در حین تخلیه به تفاوت پتانسیل الکتروشیمیایی بین مواد آند و کاتد بستگی دارد که معمولاً برای سلولهای تجاری سدیم-یون در محدوده ۲٫۵ تا ۳٫۷ ولت قرار دارد.
در حین شارژ، یک ولتاژ خارجی بیشتر از ولتاژ مدار باز سلول اعمال میشود که واکنشهای الکتروشیمیایی را معکوس میکند. یونهای سدیم از طریق اکسیداسیون از کاتد خارج میشوند:
کاتد (اکسیداسیون):
Na–Host → Na⁺ + e⁻ + Host
یونهای آزاد شده Na⁺ از طریق الکترولیت به سمت آند حرکت میکنند، در حالی که الکترونها از طریق منبع تغذیه خارجی بازمیگردند. در آند، کاهش زمانی اتفاق میافتد که یونهای Na⁺ با الکترونها ترکیب شده و دوباره در ماتریس کربنی نفوذ میکنند:
آند (کاهش):
Na⁺ + e⁻ → Na (intercalated)
این فرآیند، انرژی ذخیرهشده در باتری را بازیابی میکند و آن را برای چرخه تخلیه بعدی آماده میسازد. انتقال مؤثر شارژ، واکنشهای جانبی حداقلی و پایداری ساختاری مواد الکترودی برای دستیابی به طول عمر زیاد چرخه و بازده کولنی بالا حیاتی هستند—این دو شاخص کلیدی برای امکانپذیری تجاری محسوب میشوند.
الکترولیت—که معمولاً یک نمک سدیم (مانند NaClO₄ یا NaPF₆) در حلالهای آلی کربناتی است—نقش محوری در انتقال سریع یونها در عین حفظ پایداری الکتروشیمیایی ایفا میکند. در چرخههای شارژ اولیه، لایهای از بینفاز جامد-الکترولیت (SEI) روی سطح کاتد تشکیل میشود. این لایه پسیو شده از تجزیه بیشتر الکترولیت جلوگیری میکند، در عین حال اجازه عبور یونهای Na⁺ را میدهد—تعادل ظریفی که برای ایمنی و طول عمر ضروری است.
فراوانی طبیعی سدیم (بیش از ۱۰۰۰ برابر فراوانتر از لیتیوم در پوسته زمین) منجر به کاهش هزینه مواد و کاهش ریسک عرضه ناشی از مسائل ژئوپولیتیکی میشود. علاوه بر این، آلومینیوم میتواند به عنوان جمعکننده جریان در کاتد باتریهای سدیم-یونی استفاده شود (برخلاف باتریهای لیتیوم-یونی که به مس نیاز دارند) که این امر هزینه، وزن و را کاهش میدهد. با این حال، یونهای سدیم بزرگتر و سنگینتر از یونهای لیتیوم هستند و در نتیجه چگالی انرژی کمی پایینتر و سینتیک نفوذ آهستهتری دارند. تحقیقات جاری بر توسعه معماریهای پیشرفته الکترود، مواد نانوساختار و الکترولیتهای حالت جامد برای غلبه بر این محدودیتها متمرکز است.
مکانیسمهای شارژ و دشارژ باتریهای سدیم-یون، هماهنگی زیبایی بین علم مواد و الکتروشیمی را نشان میدهند و پایهای محکم برای نسل بعدی ذخیرهسازی انرژی فراهم میکنند. برخلاف باتریهای لیتیوم-یون، استفاده از سدیم که منبعی فراوان و کمهزینه است، نه تنها ریسکهای زنجیره تأمین را کاهش میدهد، بلکه با اهداف جهانی پایداری نیز همسو است. با اینکه پژوهشگران بهطور مداوم ترکیب الکترودها را بهبود میبخشند — تا پایداری و چگالی انرژی افزایش یابد — فرمولاسیون الکترولیت را بهینه میکنند تا عمر چرخهای و ایمنی بهبود یابد، و فرآیندهای تولید در مقیاس بزرگ را پیش میبرند تا هزینههای تولید کاهش یابد، فناوری سدیم-یون به تدریج موانع فنی باقیمانده را از میان میبرد. این پیشرفت، باتریهای Na-ion را به عنوان عاملی تحولآفرین در کاهش کربن سیستمهای انرژی در سراسر جهان، از ذخیرهسازی در مقیاس شبکه که ادغام انرژیهای تجدیدپذیر را پشتیبانی میکند تا تأمین انرژی قابل حمل و حملونقل الکتریکی کمسرعت، معرفی میکند. با بهرهگیری از حرکت ساده اما قدرتمند یونهای سدیم، ما تنها به ذخیرهسازی برق به شکلی کارآمد و مقرونبهصرفه نمیپردازیم، بلکه آیندهای از انرژی دستیافتنیتر، انعطافپذیرتر و پایدارتر را میسازیم. این فناوری شکاف بین نوآوری فناورانه و کاربرد عملی را پُر میکند و مسیری عملی برای کاهش انتشار کربن و ایجاد یک اکوسیستم انرژی جهانی سبزتر ارائه میدهد.
 اخبار داغ
اخبار داغ