เมื่อความต้องการทั่วโลกสำหรับโซลูชันการจัดเก็บพลังงานที่ยั่งยืนและมีต้นทุนต่ำเพิ่มสูงขึ้น แบตเตอรี่ไอออนโซเดียม (Na-ion) ได้ก้าวขึ้นมาเป็นทางเลือกที่น่าสนใจแทนเทคโนโลยีลิเธียมไอออน (Li-ion) แบบดั้งเดิม ด้วยวัตถุดิบที่มีอยู่มาก ผลกระทบต่อสิ่งแวดล้อมที่ต่ำกว่า และสมรรถนะทางอิเล็กโทรเคมีที่น่าประทับใจ ทำให้แบตเตอรี่ Na-ion ได้รับความนิยมเพิ่มขึ้นอย่างรวดเร็วในหลายแอปพลิเคชัน ตั้งแต่ระบบจัดเก็บพลังงานระดับโครงข่ายไฟฟ้า ไปจนถึงยานยนต์ไฟฟ้าและอุปกรณ์อิเล็กทรอนิกส์สำหรับผู้บริโภค แก่นแท้ของนวัตกรรมนี้คือกระบวนการอิเล็กโทรเคมีพื้นฐาน: การเคลื่อนที่แบบย้อนกลับได้ของไอออนโซเดียมระหว่างแคโทดและแอนโอดในช่วงการชาร์จและการคายประจุ ในบทความนี้ เราจะสำรวจกลไกที่ซับซ้อนซึ่งควบคุมรอบการชาร์จและการคายประจุของแบตเตอรี่ไอออนโซเดียม เพื่อทำความเข้าใจว่าทำไมเทคโนโลยีนี้จึงอยู่ในตำแหน่งที่พร้อมจะเปลี่ยนโฉมอนาคตของการจัดเก็บพลังงาน
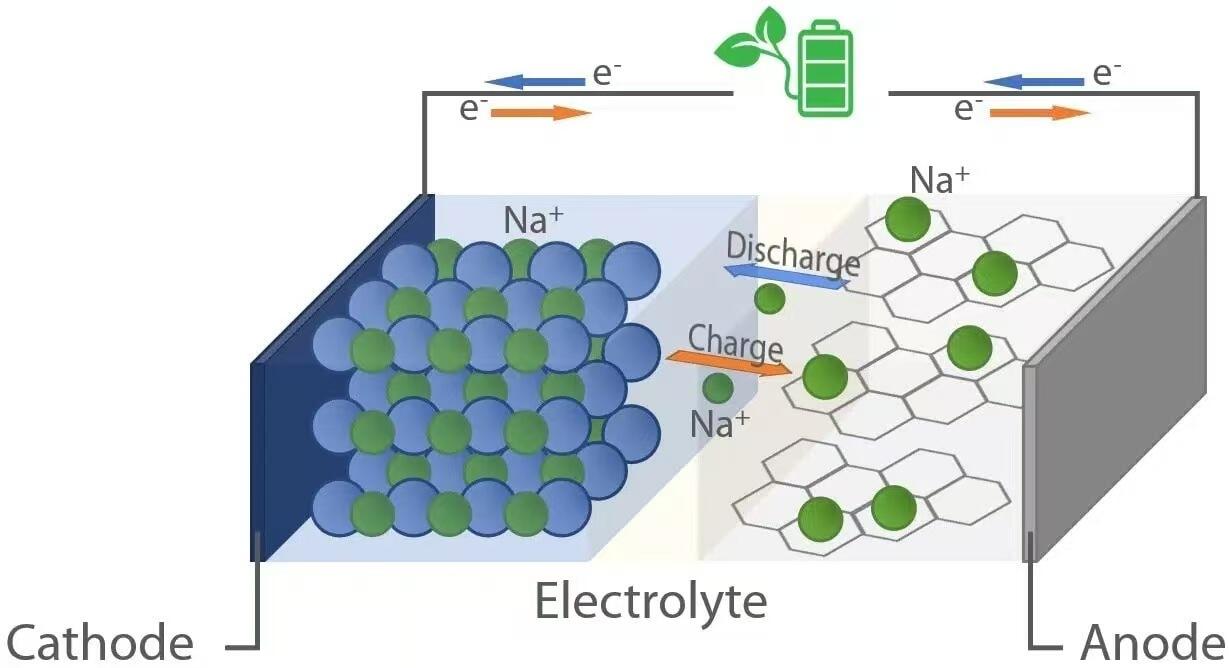
เช่นเดียวกับแบตเตอรี่ลิเทียมไอออน แบตเตอรี่โซเดียมไอออนทำงานตามหลักการทางอิเล็กโทรเคมีแบบ "ร็อกกิ้งแชร์" ระหว่างการคายประจุ—เมื่อแบตเตอรี่จ่ายพลังงานให้กับอุปกรณ์—ไอออนของโซเดียม (Na⁺) จะเคลื่อนที่จากแอโนด (ขั้วลบ) ผ่านอิเล็กโทรไลต์ไปยังแคโทด (ขั้วบวก) พร้อมกันนั้น อิเล็กตรอนจะไหลผ่านวงจรภายนอก เพื่อส่งพลังงานไฟฟ้าไปยังโหลดที่เชื่อมต่อไว้ ในทางกลับกัน ขณะชาร์จ แหล่งจ่ายไฟภายนอกจะผลักดันไอออนโซเดียมกลับจากแคโทดไปยังแอโนด เพื่อเก็บพลังงานไว้ใช้ในอนาคต การเคลื่อนย้ายไอออนแบบย้อนกลับได้นี้ เกิดขึ้นได้ด้วยวัสดุตัวรองรับในทั้งสองขั้วไฟฟ้า ซึ่งสามารถแทรก (intercalate) และถอด (deintercalate) ไอออนโซเดียมออกได้อย่างย้อนกลับโดยไม่ทำให้โครงสร้างเสื่อมสภาพอย่างมีนัยสำคัญ
เมื่อแบตเตอรี่ไอออนโซเดียมคายประจุ กระบวนการออกซิเดชันจะเกิดขึ้นที่แอโนด วัสดุแอโนดที่ใช้บ่อย ได้แก่ คาร์บอนแข็ง ซึ่งมีโครงสร้างไม่เป็นระเบียบพร้อมรูพรุนขนาดนาโนที่สามารถรองรับไอออน Na⁺ ได้ ในขณะที่แบตเตอรี่จ่ายพลังงาน อะตอมของโซเดียมภายในแอโนดจะปล่อยอิเล็กตรอน (e⁻) ออกมาและกลายเป็นไอออน Na⁺:
แอโนด (ออกซิเดชัน):
Na → Na⁺ + e⁻
อิเล็กตรอนเหล่านี้จะเคลื่อนที่ผ่านวงจรภายนอกเพื่อจ่ายพลังงานให้กับอุปกรณ์ ขณะที่ไอออน Na⁺ จะเคลื่อนที่ผ่านอิเล็กโทรไลต์ของเหลวหรือของแข็งไปยังแคโทด ที่แคโทด—ซึ่งโดยทั่วไปทำมาจากออกไซด์ของโลหะทรานซิชันแบบชั้น (เช่น NaₓMO₂ โดยที่ M = Mn, Fe, Ni เป็นต้น), สารประกอบโพลีแอนไอออนิก หรือสารคล้ายพรัสเซียนบลู—จะเกิดกระบวนการรีดักชัน เมื่อไอออน Na⁺ และอิเล็กตรอนที่เข้ามาถูกรวมเข้าไปในโครงผลึก:
แคโทด (รีดักชัน):
Na⁺ + e⁻ + Host → Na–Host
การใส่วัสดุนี้ช่วยเพิ่มความเสถียรให้กับโครงสร้างแคโทดและทำให้วงจรไฟฟ้าเคมีครบวงจร แรงดันไฟฟ้าที่เกิดขึ้นระหว่างการคายประจขึ้นอยู่กับความต่างศักย์ไฟฟ้าเคมีระหว่างวัสดุแอโนดและแคโทด โดยทั่วไปจะอยู่ในช่วง 2.5 ถึง 3.7 โวลต์ สำหรับเซลล์ Na-ion เชิงพาณิชย์
ระหว่างการชาร์จ จะมีการประยุกต์ใช้แรงดันภายนอกที่สูงกว่าแรงดันวงจรเปิดของเซลล์ ซึ่งจะทำให้ปฏิกิริยาไฟฟ้าเคมีเกิดย้อนกลับ ไอออนโซเดียมจะถูกดึงออกจากแคโทดผ่านกระบวนการออกซิเดชัน:
แคโทด (ออกซิเดชัน):
Na–Host → Na⁺ + e⁻ + Host
ไอออน Na⁺ ที่ปล่อยออกมาจะเคลื่อนที่ผ่านอิเล็กโทรไลต์กลับไปยังแอโนด ในขณะที่อิเล็กตรอนจะไหลกลับผ่านแหล่งจ่ายไฟภายนอก ที่แอโนดจะเกิดกระบวนการรีดักชัน เมื่อไอออน Na⁺ รวมตัวกับอิเล็กตรอนและแทรกกลับเข้าไปในแมทริกซ์คาร์บอน:
แอโนด (รีดักชัน):
Na⁺ + e⁻ → Na (intercalated)
กระบวนการนี้ช่วยฟื้นฟูพลังงานที่สะสมอยู่ในแบตเตอรี่ เพื่อเตรียมความพร้อมสำหรับรอบการคายประจุครั้งต่อไป การถ่ายโอนประจุอย่างมีประสิทธิภาพ ปฏิกิริยาข้างเคียงต่ำ และความเสถียรของโครงสร้างวัสดุขั้วไฟฟ้า มีความสำคัญอย่างยิ่งต่อการบรรลุอายุการใช้งานยาวนานและประสิทธิภาพคูลอมบ์สูง ซึ่งเป็นตัวชี้วัดหลักสำหรับความสามารถในการนำไปใช้เชิงพาณิชย์
อิเล็กโทรไลต์—โดยทั่วไปเป็นเกลือโซเดียม (เช่น NaClO₄ หรือ NaPF₆) ที่ละลายในตัวทำละลายคาร์บอเนตอินทรีย์—มีบทบาทสำคัญในการทำให้การขนส่งไอออนเกิดขึ้นได้อย่างรวดเร็ว ขณะเดียวกันก็รักษาระดับเสถียรภาพทางอิเล็กโทรเคมีไว้ได้ ในระหว่างรอบการชาร์จครั้งแรก จะมีการก่อตัวของชั้นเปลี่ยนผ่านของแข็งกับอิเล็กโทรไลต์ (SEI) บนพื้นผิวของแอโนด ชั้นป้องกันนี้ช่วยป้องกันไม่ให้อิเล็กโทรไลต์สลายตัวเพิ่มเติม แต่ยังคงอนุญาตให้ไอออน Na⁺ ผ่านเข้าออกได้ ซึ่งเป็นสมดุลที่ละเอียดอ่อนและจำเป็นต่อความปลอดภัยและความทนทานยาวนาน
ความอุดมสมบูรณ์ตามธรรมชาติของโซเดียม (มีมากกว่าลิเธียมถึงกว่า 1,000 เท่าในเปลือกโลก) ส่งผลให้ต้นทุนวัสดุต่ำลงและลดความเสี่ยงด้านการจัดหาที่เกี่ยวข้องกับภูมิรัฐศาสตร์ อีกทั้งยังสามารถใช้อะลูมิเนียมเป็นตัวนำไฟฟ้าสำหรับขั้วลบในแบตเตอรี่โซเดียม-ไอออนได้ (ซึ่งต่างจากแบตเตอรี่ลิเธียม-ไอออนที่ต้องใช้ทองแดง) ช่วยลดต้นทุนและน้ำหนักเพิ่มเติมอย่างไรก็ตาม ไอออนของโซเดียมมีขนาดและน้ำหนักมากกว่าไอออนลิเธียม ทำให้มีความหนาแน่นพลังงานต่ำกว่าเล็กน้อย และการแพร่กระจายของไอออนช้ากว่า ปัจจุบันงานวิจัยต่างๆ มุ่งเน้นไปที่การพัฒนาโครงสร้างขั้วไฟฟ้าขั้นสูง วัสดุที่มีโครงสร้างระดับนาโน และอิเล็กโทรไลต์แบบแข็ง เพื่อแก้ไขข้อจำกัดเหล่านี้
กลไกการชาร์จและปล่อยประจุของแบตเตอรี่ไอออนโซเดียมแสดงให้เห็นถึงความร่วมมืออันลงตัวระหว่างวิทยาศาสตร์วัสดุและเคมีไฟฟ้า ซึ่งเป็นรากฐานที่มั่นคงสำหรับระบบจัดเก็บพลังงานรุ่นต่อไป ต่างจากแบตเตอรี่ลิเธียมไอออน แบตเตอรี่ชนิดนี้ใช้โซเดียมที่มีอยู่มากและมีต้นทุนต่ำ ไม่เพียงแต่ช่วยลดความเสี่ยงด้านห่วงโซ่อุปทาน แต่ยังสอดคล้องกับเป้าหมายความยั่งยืนระดับโลก อีกทั้งเมื่อนักวิจัยพัฒนาองค์ประกอบของขั้วไฟฟ้าอย่างต่อเนื่องเพื่อเพิ่มความเสถียรและหนาแน่นพลังงาน พัฒนาสูตรอิเล็กโทรไลต์เพื่อยืดอายุการใช้งานและเพิ่มความปลอดภัย รวมถึงปรับปรุงกระบวนการผลิตในขนาดใหญ่เพื่อลดต้นทุนการผลิต เทคโนโลยีโซเดียมไอออนจึงสามารถก้าวข้ามอุปสรรคทางเทคนิคที่เหลืออยู่ได้อย่างต่อเนื่อง ความก้าวหน้านี้ทำให้แบตเตอรี่ Na-ion มีบทบาทสำคัญในการลดการปล่อยคาร์บอนจากระบบพลังงานทั่วโลก ตั้งแต่ระบบจัดเก็บพลังงานขนาดใหญ่ที่สนับสนุนการผนวกพลังงานหมุนเวียน ไปจนถึงแหล่งพลังงานแบบพกพาและการขนส่งด้วยยานยนต์ไฟฟ้าความเร็วต่ำ โดยการใช้ประโยชน์จากการเคลื่อนที่ที่เรียบง่ายแต่มีประสิทธิภาพของไอออนโซเดียม เราไม่เพียงแค่จัดเก็บไฟฟ้าได้อย่างมีประสิทธิภาพและราคาไม่แพงเท่านั้น แต่กำลังสร้างอนาคตด้านพลังงานที่เข้าถึงได้ง่ายกว่า มั่นคงกว่า และยั่งยืนมากกว่า ด้วยการเชื่อมช่องว่างระหว่างนวัตกรรมทางเทคโนโลยีกับการประยุกต์ใช้งานจริง พร้อมเสนอแนวทางที่เป็นไปได้ในการลดการปล่อยก๊าซคาร์บอนและสร้างระบบนิเวศพลังงานโลกที่เป็นมิตรกับสิ่งแวดล้อมมากขึ้น