مع تزايد الطلب العالمي على حلول تخزين الطاقة المستدامة والفعالة من حيث التكلفة، برزت بطاريات أيون الصوديوم (Na-ion) كخيار جذاب يُنافس تقنيات الليثيوم-أيون (Li-ion) التقليدية. وبفضل توفر المواد الخام بكثرة، وانخفاض الأثر البيئي، والأداء الكهروكيميائي الواعد، فإن بطاريات أيون الصوديوم تكتسب زخمًا متزايدًا في تطبيقات متنوعة تتراوح من أنظمة تخزين الطاقة على مستوى الشبكات إلى المركبات الكهربائية والإلكترونيات الاستهلاكية. وفي صميم هذه الابتكار تكمن عملية كهروكيميائية أساسية: الحركة العكسية لأيونات الصوديوم بين المهبط والمصعد أثناء الشحن والتفريغ. في هذا المقال، نستعرض الآليات المعقدة التي تحكم دورة شحن وتفريغ بطاريات أيون الصوديوم، ونسلط الضوء على السبب الذي يجعل هذه التكنولوجيا قادرة على إعادة تشكيل مستقبل تخزين الطاقة.
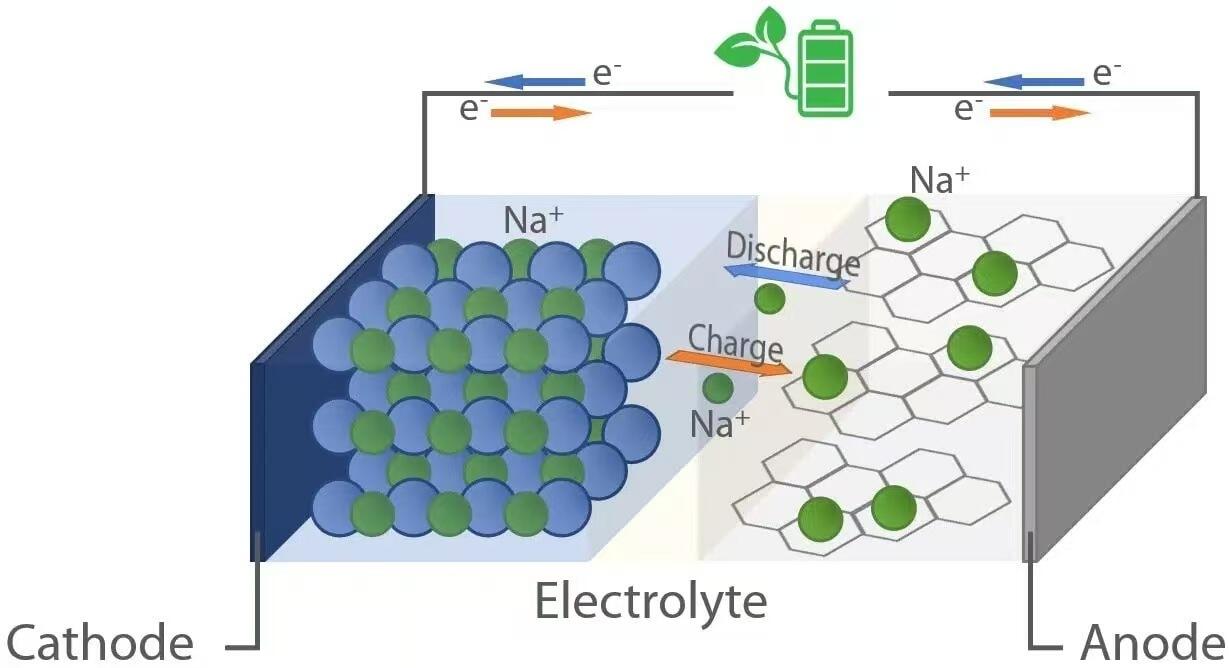
تمامًا مثل بطاريات الليثيوم أيون، تعمل بطاريات الصوديوم أيون على مبدأ الكيمياء الكهربائية من نوع "التأرجح". أثناء التفريغ—عندما تُزوّد البطارية جهازًا بالطاقة—تنتقل أيونات الصوديوم (Na⁺) من المصعد (القطب السالب) عبر الإلكتروليت إلى المهبط (القطب الموجب). في الوقت نفسه، تتدفق الإلكترونات عبر الدائرة الخارجية، مما يُزوّد الحمل المتصل بالطاقة الكهربائية. على العكس، أثناء الشحن، يقوم مصدر طاقة خارجي بدفع أيونات الصوديوم عائدًا من المهبط إلى المصعد، لتخزين الطاقة للاستخدام المستقبلي. يتم تسهيل هذه العملية العكسية لنقل الأيونات بواسطة مواد مضيفة في كلا القطبين يمكنها إدخال (إدراج) واستخراج (إزالة) أيونات الصوديوم بشكل عكسي دون حدوث تدهور هيكلي كبير.
عندما يتم تفريغ بطارية أيون الصوديوم، يحدث أكسدة عند المصعد. وتشمل المواد الشائعة للمصعد الفحم الصلب، الذي يمتلك بنية غير منظمة مع مسام نانوية قادرة على استيعاب أيونات Na⁺. وعندما تزود البطارية الطاقة، فإن ذرات الصوديوم داخل المصعد تطلق إلكترونات (e⁻) وتتحول إلى أيونات Na⁺:
المصعد (الأكسدة):
Na → Na⁺ + e⁻
ثم تنتقل هذه الإلكترونات عبر الدائرة الخارجية لتشغيل الأجهزة، في حين تتحرك أيونات Na⁺ عبر الإلكتروليت السائل أو الصلب نحو المهبط. وفي المهبط - الذي يتكون عادةً من أكاسيد المعادن الانتقالية الطبقة (مثل NaₓMO₂، حيث M = Mn، Fe، Ni، إلخ)، أو المركبات متعددة الأنيونات، أو مركبات مشابهة للزرنيخ الأزرق - يحدث اختزال عندما تنضم أيونات Na⁺ والإلكترونات الواردة إلى شبيكة البلورة:
المهبط (الاختزال):
Na⁺ + e⁻ + Host → Na–Host
يُثبّت هذا الإدخال هيكل الكاثود ويُكمل الدائرة الكهروكيميائية. ويعتمد الجهد الناتج أثناء التفريغ على الفرق في الجهد الكهروكيميائي بين مواد الأنود والكاثود، ويتراوح عادةً بين 2.5 و3.7 فولت للخلايا التجارية لأيون الصوديوم.
أثناء الشحن، يتم تطبيق جهد خارجي أكبر من جهد الدائرة المفتوحة للخلية، مما يعكس التفاعلات الكهروكيميائية. ويتم استخلاص أيونات الصوديوم من الكاثود عن طريق الأكسدة:
الكاثود (الأكسدة):
Na–Host → Na⁺ + e⁻ + Host
تعبر أيونات Na⁺ المحررة عبر الإلكتروليت عائدة إلى الأنود، في حين تعود الإلكترونات عبر مصدر الطاقة الخارجي. وعند الأنود، يحدث الاختزال عندما تتحد أيونات Na⁺ مع الإلكترونات وتنفذ مجددًا في شبكة الكربون:
الأنود (الاختزال):
Na⁺ + e⁻ → Na (مندمجة)
تُعيد هذه العملية شحن الطاقة المخزنة في البطارية، مما يُهيئها للدورة التالية لتفريغ الشحنة. وتعتبر كفاءة نقل الشحنة، والتفاعلات الجانبية الدنيا، والاستقرار البنيوي لمواد الإلكترود أمورًا بالغة الأهمية لتحقيق عمر دورة طويل وكفاءة كولومبية عالية — وهي مقاييس رئيسية لجدوى الاستخدام التجاري.
يلعب الإلكتروليت — الذي يكون عادة ملح الصوديوم (مثل NaClO₄ أو NaPF₆) المذاب في مذيبات كربونات عضوية — دورًا محوريًا في تمكين النقل السريع للأيونات مع الحفاظ على الثبات الكهروكيميائي. خلال الدورات الأولى من الشحن، يتكون طبقة تفاعل الإلكتروليت الصلبة (SEI) على سطح المصعد. وتمنع هذه الطبقة العازلة تحلل الإلكتروليت الإضافي مع السماح لأيونات Na⁺ بالمرور من خلالها — وهو توازن دقيق ضروري للسلامة والعمر الطويل.
وفرة الصوديوم الطبيعية (أكثر بوجوده بمقدار أكثر من 1000 مرة من الليثيوم في القشرة الأرضية) تُترجم إلى تكاليف مواد أقل وانخفاض مخاطر توريد جيوسياسية. بالإضافة إلى ذلك، يمكن استخدام الألومنيوم كمجمع تيار للقطب السالب في بطاريات أيون الصوديوم (على عكس بطاريات أيون الليثيوم التي تتطلب النحاس)، مما يقلل التكاليف والوزن بشكل أكبر. ومع ذلك، فإن أيونات الصوديوم أكبر وأثقل من أيونات الليثيوم، مما يؤدي إلى كثافة طاقة أقل قليلاً وإلى حركية انتشار أبطأ. ويتركز البحث الجارِ على تطوير هياكل إلكترود متقدمة، ومواد نانوية ذات بنية خاصة، وإلكتروليتات صلبة للتغلب على هذه القيود.
تُجسّد آليات الشحن والتفريغ لبطاريات أيون الصوديوم التآزر الأنيق بين علوم المواد والكيمياء الكهربائية، مما يضع أساسًا متينًا لتخزين الطاقة من الجيل التالي. وعلى عكس بطاريات أيون الليثيوم، فإن اعتمادها على مادة الصوديوم الوافرة ومنخفضة التكلفة لا يقلل فقط من مخاطر سلسلة التوريد، بل يتماشى أيضًا مع أهداف الاستدامة العالمية. ومع استمرار الباحثين في تحسين تركيبات الأقطاب الكهربائية لتعزيز الثبات وكثافة الطاقة، وتحسين تركيبات الإلكتروليت لزيادة عمر الدورة والسلامة، وتقدم عمليات التصنيع على نطاق واسع لتقليل تكاليف الإنتاج، فإن تقنية بطاريات الصوديوم تتجاوز تدريجيًا العوائق التقنية المتبقية. ويُمكّن هذا التقدم بطاريات Na-ion من القيام بدور تحويلي في إزالة الكربون من أنظمة الطاقة حول العالم، بدءًا من أنظمة التخزين على مستوى الشبكة التي تدعم دمج الطاقة المتجددة، مرورًا بالطاقة المتنقلة، ووصولًا إلى التنقل الكهربائي منخفض السرعة. وباستغلال الحركة البسيطة لكن القوية لأيونات الصوديوم، نحن لا نكتفي بتخزين الكهرباء بكفاءة وبتكلفة مناسبة، بل نحن نُشكّل مستقبلًا للطاقة أكثر إمكانيةً للوصول إليه وأكثر مرونة واستدامة. إنها تسد الفجوة بين الابتكار التكنولوجي والتطبيق العملي، وتوفر طريقًا قابلاً للتطبيق للحد من انبعاثات الكربون وبناء نظام طاقة عالمي أنظف.
 أخبار ساخنة
أخبار ساخنة