Mentre la domanda globale di soluzioni per lo stoccaggio dell'energia sostenibili ed economiche intensifica, le batterie al sodio-ione (Na-ione) si sono affermate come un'alternativa convincente rispetto alle tradizionali tecnologie al litio-ione (Li-ione). Grazie alla disponibilità abbondante di materie prime, a un minore impatto ambientale e a prestazioni elettrochimiche promettenti, le batterie Na-ione stanno rapidamente guadagnando terreno in applicazioni che vanno dall'accumulo di energia su scala di rete ai veicoli elettrici e all'elettronica di consumo. Al centro di questa innovazione vi è un processo elettrochimico fondamentale: il movimento reversibile degli ioni di sodio tra catodo e anodo durante le fasi di carica e scarica. In questo articolo esploreremo i meccanismi complessi che regolano i cicli di carica e scarica delle batterie al sodio-ione, analizzando il motivo per cui questa tecnologia è destinata a ridefinire il futuro dello stoccaggio dell'energia.
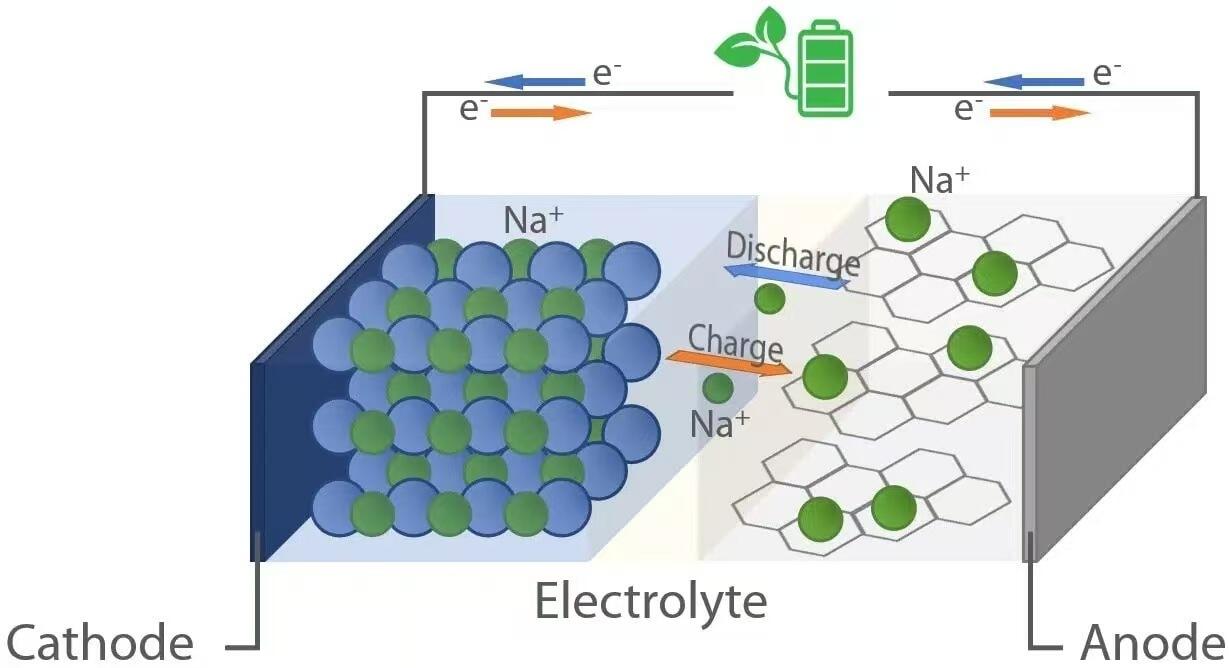
Come le loro controparti agli ioni di litio, le batterie agli ioni di sodio funzionano secondo il principio dell'elettrochimica a "rocking-chair". Durante la scarica—quando la batteria alimenta un dispositivo—gli ioni di sodio (Na⁺) migrano dall'anodo (elettrodo negativo) attraverso l'elettrolita verso il catodo (elettrodo positivo). Contemporaneamente, gli elettroni fluiscono attraverso il circuito esterno, fornendo energia elettrica al carico collegato. Al contrario, durante la ricarica, una fonte di alimentazione esterna riporta gli ioni di sodio dal catodo all'anodo, immagazzinando energia per un uso futuro. Questo movimento reversibile degli ioni è facilitato da materiali ospitanti in entrambi gli elettrodi, capaci di intercalare (inserire) e deintercalare (estrarre) ioni di sodio senza un significativo degrado strutturale.
Quando una batteria a ioni di sodio si scarica, all'anodo avviene l'ossidazione. I materiali comuni per l'anodo includono il carbonio duro, che possiede una struttura disordinata con nanopori capaci di ospitare ioni Na⁺. Mentre la batteria eroga energia, gli atomi di sodio all'interno dell'anodo rilasciano elettroni (e⁻) e diventano ioni Na⁺:
Anodo (Ossidazione):
Na → Na⁺ + e⁻
Questi elettroni viaggiano attraverso il circuito esterno per alimentare i dispositivi, mentre gli ioni Na⁺ si muovono attraverso l'elettrolita liquido o solido verso il catodo. Al catodo—tipicamente composto da ossidi stratificati di metalli di transizione (ad esempio NaₓMO₂, dove M = Mn, Fe, Ni, ecc.), composti polianionici o analoghi del blu di Prussia—avviene la riduzione, poiché gli ioni Na⁺ ed elettroni in arrivo vengono incorporati nel reticolo cristallino:
Catodo (Riduzione):
Na⁺ + e⁻ + Host → Na–Host
Questa inserzione stabilizza la struttura del catodo e completa il circuito elettrochimico. La tensione generata durante la scarica dipende dalla differenza di potenziale elettrochimico tra i materiali dell'anodo e del catodo, che in genere varia da 2,5 a 3,7 volt per celle al sodio di tipo commerciale.
Durante la carica, viene applicata una tensione esterna superiore alla tensione a circuito aperto della cella, invertendo così le reazioni elettrochimiche. Gli ioni di sodio vengono estratti dal catodo attraverso l'ossidazione:
Catodo (Ossidazione):
Na–Host → Na⁺ + e⁻ + Host
Gli ioni Na⁺ rilasciati attraversano l'elettrolita per tornare all'anodo, mentre gli elettroni ritornano tramite la sorgente di alimentazione esterna. All'anodo avviene la riduzione, quando gli ioni Na⁺ si combinano con gli elettroni e si reinserrano nella matrice carboniosa:
Anodo (Riduzione):
Na⁺ + e⁻ → Na (intercalato)
Questo processo ripristina l'energia immagazzinata nella batteria, preparandola per il successivo ciclo di scarica. Un trasferimento di carica efficiente, reazioni secondarie minime e la stabilità strutturale dei materiali degli elettrodi sono fondamentali per ottenere una lunga vita ciclica e un'elevata efficienza coulombica—parametri chiave per la sostenibilità commerciale.
L'elettrolita—generalmente un sale di sodio (ad esempio NaClO₄ o NaPF₆) disciolto in solventi organici a base di carbonato—svolge un ruolo cruciale nel consentire un rapido trasporto ionico mantenendo al contempo la stabilità elettrochimica. Durante i primi cicli di carica, si forma sulla superficie dell'anodo uno strato intermedio solido-elettrolita (SEI). Questo strato passivante impedisce ulteriori decomposizioni dell'elettrolita permettendo al contempo il passaggio degli ioni Na⁺—un equilibrio delicato essenziale per sicurezza e longevità.
L'abbondanza naturale del sodio (più di 1.000 volte superiore a quella del litio nella crosta terrestre) si traduce in costi dei materiali inferiori e minori rischi geopolitici di approvvigionamento. Inoltre, l'alluminio può essere utilizzato come collettore di corrente per l'anodo nelle batterie al sodio (a differenza delle batterie al litio, che richiedono rame), riducendo ulteriormente costi e peso. Tuttavia, gli ioni di sodio sono più grandi e pesanti degli ioni di litio, il che comporta una densità energetica leggermente inferiore e cinetiche di diffusione più lente. La ricerca in corso si concentra sullo sviluppo di architetture avanzate per gli elettrodi, materiali nanostrutturati ed elettroliti allo stato solido per superare questi limiti.
I meccanismi di carica e scarica delle batterie al sodio-ion esemplificano l'elegante sinergia tra scienza dei materiali ed elettrochimica, gettando solide basi per lo stoccaggio dell'energia della prossima generazione. A differenza delle controparti al litio, la loro dipendenza dal sodio, abbondante e a basso costo, non solo riduce i rischi legati alla catena di approvvigionamento, ma si allinea anche agli obiettivi globali di sostenibilità. Mentre i ricercatori continuano a perfezionare le composizioni degli elettrodi — migliorando stabilità e densità energetica — ottimizzando le formulazioni degli elettroliti per aumentare la durata ciclica e la sicurezza, e sviluppando processi produttivi su larga scala per abbattere i costi di produzione, la tecnologia al sodio-ion sta progressivamente superando gli ostacoli tecnici rimanenti. Questo progresso colloca le batterie Na-ion in una posizione chiave per svolgere un ruolo trasformativo nella decarbonizzazione dei sistemi energetici mondiali, dallo stoccaggio su scala di rete che supporta l'integrazione delle energie rinnovabili, fino all'alimentazione portatile e alla mobilità elettrica a bassa velocità. Sfruttando il semplice ma potente movimento degli ioni di sodio, non stiamo solo immagazzinando elettricità in modo efficiente ed economico — stiamo costruendo un futuro energetico più accessibile, resiliente e sostenibile. Tale tecnologia colma il divario tra innovazione tecnologica e applicazione pratica, offrendo un percorso praticabile per ridurre le emissioni di carbonio e creare un ecosistema energetico globale più verde.
 Notizie di rilievo
Notizie di rilievo