Mit der zunehmenden globalen Nachfrage nach nachhaltigen und kosteneffizienten Energiespeicherlösungen haben Natrium-Ionen-(Na-Ionen-)Batterien sich als überzeugende Alternative zu herkömmlichen Lithium-Ionen-(Li-Ionen-)Technologien etabliert. Aufgrund des reichlichen Vorkommens der Rohstoffe, einer geringeren Umweltbelastung und einer vielversprechenden elektrochemischen Leistung gewinnen Na-Ionen-Batterien zunehmend an Bedeutung in Anwendungen, die von stationären Stromnetzspeichern bis hin zu Elektrofahrzeugen und Unterhaltungselektronik reichen. Im Zentrum dieser Innovation steht ein grundlegender elektrochemischer Prozess: die reversible Bewegung von Natriumionen zwischen Kathode und Anode während der Lade- und Entladevorgänge. In diesem Artikel untersuchen wir die komplexen Mechanismen, die die Lade- und Entladezyklen von Natrium-Ionen-Batterien bestimmen, und erläutern, warum diese Technologie bereitsteht, die Zukunft der Energiespeicherung neu zu gestalten.
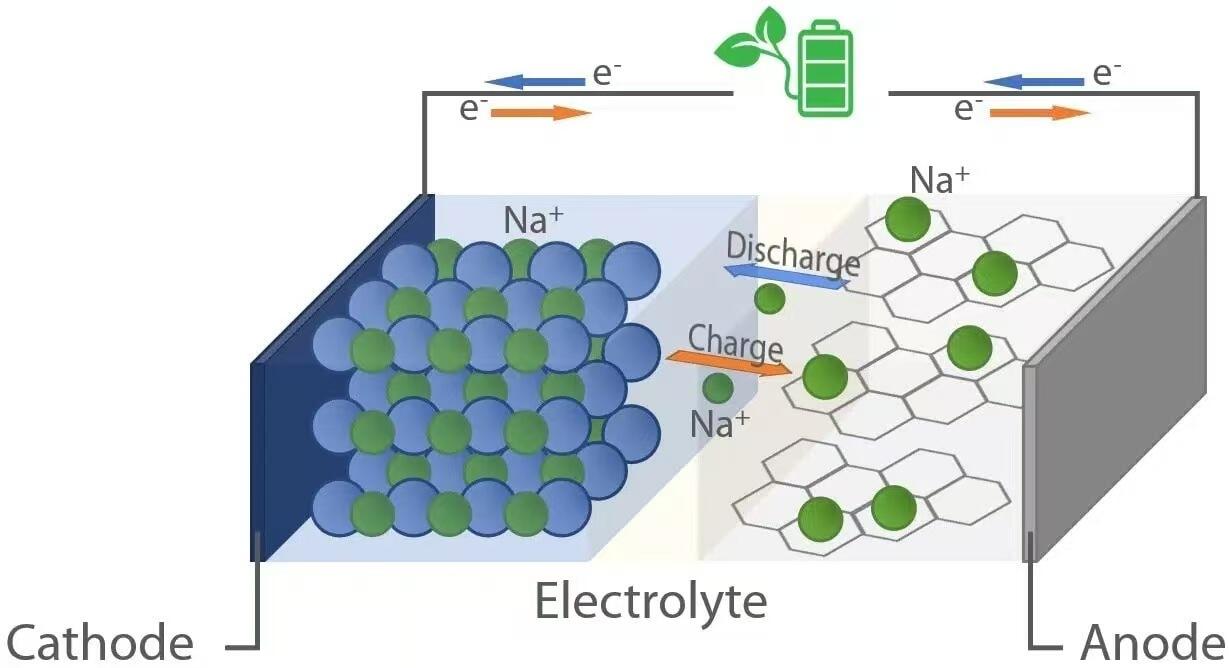
Wie ihre Lithium-Ionen-Pendants funktionieren auch Natrium-Ionen-Batterien nach dem Prinzip der „Rocking-Chair“-Elektrochemie. Während der Entladung – wenn die Batterie ein Gerät mit Energie versorgt – wandern Natriumionen (Na⁺) von der Anode (negativen Elektrode) durch den Elektrolyten zur Kathode (positive Elektrode). Gleichzeitig fließen Elektronen durch den externen Stromkreis und liefern elektrische Energie an die angeschlossene Last. Umgekehrt treibt während des Ladevorgangs eine externe Energiequelle die Natriumionen von der Kathode zurück zur Anode, wodurch Energie für die spätere Nutzung gespeichert wird. Dieser umkehrbare Ionaustausch wird durch Wirtsmaterialien in beiden Elektroden ermöglicht, die Natriumionen reversibel interkalieren (einfügen) und deinterkalieren (entfernen) können, ohne dass es zu einer erheblichen strukturellen Degradation kommt.
Wenn eine Natrium-Ionen-Batterie entladen wird, findet an der Anode eine Oxidation statt. Zu den üblichen Anodenmaterialien gehört Hartkohle, die eine ungeordnete Struktur mit Nanoporen aufweist, die in der Lage sind, Na⁺-Ionen aufzunehmen. Wenn die Batterie Strom liefert, geben Natriumatome innerhalb der Anode Elektronen (e⁻) ab und werden zu Na⁺-Ionen:
Anode (Oxidation):
Na → Na⁺ + e⁻
Diese Elektronen wandern durch den externen Stromkreis, um Geräte mit Energie zu versorgen, während die Na⁺-Ionen durch den flüssigen oder festen Elektrolyten zur Kathode wandern. An der Kathode – typischerweise bestehend aus geschichteten Übergangsmetalloxiden (z. B. NaₓMO₂, wobei M = Mn, Fe, Ni usw.), polyanionischen Verbindungen oder Analoga des Berliner Blaus – findet eine Reduktion statt, bei der Na⁺-Ionen und ankommende Elektronen im Kristallgitter eingebaut werden:
Kathode (Reduktion):
Na⁺ + e⁻ + Wirt → Na–Wirt
Diese Einlagerung stabilisiert die Kathodenstruktur und schließt den elektrochemischen Kreislauf ab. Die während der Entladung erzeugte Spannung hängt von der Differenz des elektrochemischen Potentials zwischen Anoden- und Kathodenmaterial ab und liegt typischerweise bei kommerziellen Natrium-Ionen-Zellen zwischen 2,5 und 3,7 Volt.
Während des Ladevorgangs wird eine externe Spannung angelegt, die größer ist als die Leerlaufspannung der Zelle, wodurch die elektrochemischen Reaktionen umgekehrt werden. Natriumionen werden durch Oxidation aus der Kathode herausgelöst:
Kathode (Oxidation):
Na–Wirt → Na⁺ + e⁻ + Wirt
Die freigesetzten Na⁺-Ionen wandern durch den Elektrolyten zurück zur Anode, während die Elektronen über die externe Stromquelle zurückfließen. An der Anode erfolgt die Reduktion, wenn Na⁺-Ionen sich mit Elektronen verbinden und wieder in die Kohlenstoffmatrix eingelagert werden:
Anode (Reduktion):
Na⁺ + e⁻ → Na (interkalierter Zustand)
Dieser Prozess stellt die gespeicherte Energie der Batterie wieder her und bereitet sie auf den nächsten Entladezyklus vor. Ein effizienter Ladungstransfer, minimale Nebenreaktionen und die strukturelle Stabilität der Elektrodenmaterialien sind entscheidend, um eine lange Zyklenlebensdauer und einen hohen coulombschen Wirkungsgrad zu erreichen – wichtige Kennzahlen für die kommerzielle Machbarkeit.
Der Elektrolyt – in der Regel ein Natriumsalz (z. B. NaClO₄ oder NaPF₆) in organischen Carbonatlösungsmitteln gelöst – spielt eine entscheidende Rolle bei der Gewährleistung eines schnellen Ionentransports unter gleichzeitiger Aufrechterhaltung elektrochemischer Stabilität. Während der ersten Ladezyklen bildet sich auf der Anodenoberfläche eine feste Elektrolyt-Grenzschicht (SEI). Diese Passivierungsschicht verhindert weiteren Elektrolytzerfall, erlaubt aber gleichzeitig den Durchtritt von Na⁺-Ionen – ein empfindliches Gleichgewicht, das für Sicherheit und Langlebigkeit unerlässlich ist.
Die natürliche Häufigkeit von Natrium (über 1.000-mal häufiger als Lithium in der Erdkruste) führt zu niedrigeren Materialkosten und verringert geopolitische Versorgungsrisiken. Zudem kann Aluminium als Stromabnehmer für die Anode in Na-Ionen-Batterien verwendet werden (im Gegensatz zu Li-Ionen, die Kupfer erfordern), was Kosten sowie Gewicht weiter reduziert. Allerdings sind Natriumionen größer und schwerer als Lithiumionen, was zu einer etwas geringeren Energiedichte und langsameren Diffusionskinetik führt. Laufende Forschungen konzentrieren sich darauf, fortschrittliche Elektrodenarchitekturen, nanostrukturierte Materialien und Festelektrolyte zu entwickeln, um diese Einschränkungen zu überwinden.
Die Lade- und Entladevorgänge von Natrium-Ionen-Batterien zeigen die elegante Synergie zwischen Werkstoffwissenschaft und Elektrochemie, die eine solide Grundlage für Energiespeicher der nächsten Generation bildet. Im Gegensatz zu Lithium-Ionen-Batterien verringert ihre Abhängigkeit von reichlich vorhandenem, kostengünstigem Natrium nicht nur die Risiken in der Lieferkette, sondern unterstützt auch globale Nachhaltigkeitsziele. Während Forscher kontinuierlich die Zusammensetzung der Elektroden verbessern – um Stabilität und Energiedichte zu erhöhen –, Elektrolytformulierungen optimieren, um Lebensdauer und Sicherheit zu steigern, und Fertigungsverfahren im großen Maßstab weiterentwickeln, um Produktionskosten zu senken, überwindet die Natrium-Ionen-Technologie nach und nach verbleibende technische Hürden. Dieser Fortschritt positioniert Na-Ionen-Batterien als Schlüsseltechnologie zur Dekarbonisierung weltweiter Energiesysteme, von netzgekoppelten Speichern zur Unterstützung der Integration erneuerbarer Energien bis hin zu tragbaren Stromquellen und elektrischer Mobilität mit niedriger Geschwindigkeit. Indem wir die einfache, aber leistungsfähige Bewegung von Natriumionen nutzen, speichern wir nicht nur effizient und kostengünstig elektrische Energie – wir gestalten eine zugänglichere, widerstandsfähigere und nachhaltigere Energiezukunft. Sie schließt die Lücke zwischen technologischer Innovation und praktischer Anwendung und bietet einen realisierbaren Weg, um Treibhausgasemissionen zu reduzieren und ein grüneres globales Energiesystem aufzubauen.
 Top-Nachrichten
Top-Nachrichten