Како се глобална потражња за одрживим и трошковно ефикасним решењима складиштења енергије интензивира, натријум-јонске (На-јонске) батерије постале су убедљива алтернатива традиционалним литијум-јонским (ЛИ-јонским) технологијама. Са обиљним сировинама, мањим утицајем на животну средину и обећавајућим електрохемијским перформансима, наонионске батерије брзо добијају натезање у апликацијама које се крећу од складиштења енергије у маштабу мреже до електричних возила и потрошене електронике. У срцу ове иновације лежи фундаментални електрохемијски процес: реверзибилно кретање натријумских јона између катоде и аноде током пуњења и пуњења. У овом чланку истражујемо сложене механизме који управљају циклусом пуњења и пуњења натријум-јонских батерија, осветљавајући зашто је ова технологија спремна да промени будућност складиштења енергије.
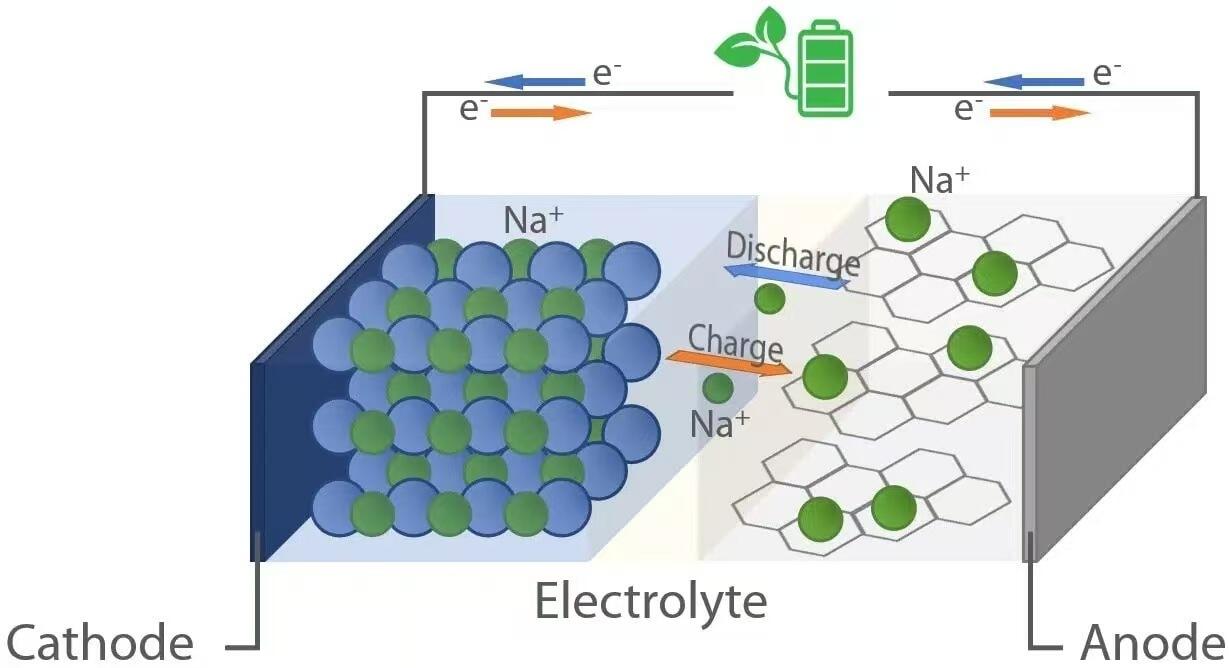
Као и њихове литијум-јонске колеге, натријум-јонске батерије раде по принципу "коцкање-стола" електрохемије. Током пуштањакада батерија напаја уређајнатријумски јони (Na+) мигрирају из аноде (негативна електрода) кроз електролит до катоде (позитивна електрода). Истовремено, електрони пролазе кроз спољни колац, доставувајући електричну енергију повезаном оптерећењу. С друге стране, током пуњења, спољни извор енергије враћа натријумске јоне из катоде у аноду, чувајући енергију за будућу употребу. Ово реверзибилно ионско ширење олакшавају материјали домаћина у обе електроде који могу реверзибилно интеркалирати (уставити) и деинтеркалирати (екстрактирати) натријумске јоне без значајне структурне деградације.
Када се натријум-јонска батерија испусти, на аноди се јавља оксидација. Уобичајени анодни материјали укључују тврди угљеник, који поседује нередну структуру са нанопорима способним да сместе На+ јоне. Како батерија испоручује енергију, натријумски атоми унутар аноде ослобађају електроне (е−) и постају Na+ јони:
Анод (оксидација):
На → На+ + е−
Ови електрони путују кроз спољни колац до уређаја за напајање, док се јони Na + крећу кроз течност или чврсти електролит према катоди. На катоди обично састављеној од слојених прелазних метала оксида (нпр. НаксМО2, где је М = Мн, Фе, Ни, итд.), полијанионски једињења, или Пруски плави аналозиредукција се одвија као На+ јони и долазећи
Катода (редукција):
На+ + е− + Хост → НаХост
Ово уношење стабилизује структуру катоде и завршава електрохемијски коло. Напетост настала током пуштања зависи од разлике у електрохемијском потенцијалу између анода и катода, обично у распону од 2,5 до 3,7 волта за комерцијалне наонионске ћелије.
Током пуњења, примењује се спољни напон већи од напона отворених кола ћелије, реверсирајући електрохемијске реакције. Натријумски јони се извучују из катоде оксидацијом:
Катода (оксидација):
НаХост → На+ + е− + Хост
Ослобођени Na+ јони пролазе кроз електролит назад до аноде, док се електрони враћају преко спољног извора енергије. На аноди, редукција се јавља док се јони На+ комбинују са електронима и поново интеркалирају у угљенску матрицу:
Анод (редукција):
На+ + е− → На (интеркалирано)
Овај процес враћа складиштене енергије батерије, припремајући је за следећи циклус пуштања. Ефикасан пренос наплате, минималне странице реакција и структурна стабилност материјала електрода су од кључног значаја за постизање дугог цикла живота и високе Куломбичке ефикасности.
Електролитобично натријумска сол (нпр. NaClO4 или NaPF6) растворена у органским карбонатским растворитељимаигра кључну улогу у омогућавању брзог транспорта јона, одржавајући електрохемијску стабилност. Током почетних циклуса пуњења, на површини аноде формира се чврста електролитска интерфаза (SEI). Овај пасивациони слој спречава даље распад електролита док омогућава ионима На+ да прођу кроз деликатну равнотежу неопходну за безбедност и дуговечност.
Природно обиље натријума (преко 1.000 пута више него литија у Земљиној коре) доводи до нижих трошкова материјала и смањења геополитичких ризика снабдевања. Додатно, алуминијум се може користити као колектор струје за аноду у На-ионским батеријама (за разлику од Литијум-ионских, које захтевају бакар), што додатно смањује трошкове и тежину. Међутим, натријумски јони су већи и тежи од литијумских јона, што резултира мало нижом густином енергије и спором дифузијском кинетиком. Тренутно истраживање фокусира се на развој напредних архитектура електрода, наноструктуираних материјала и електролита чврсте државе како би се превазишли ова ограничења.
Механизми пуњења и пуњења натријум-јонских батерија представљају пример елегантне синергије између науке о материјалима и електрохемије, постављајући чврсту основу за складиштење енергије следеће генерације. За разлику од литијум-јонских аналога, њихова зависност од обилног, јефтиног натријума не само да смањује ризике ланца снабдевања већ се и усклађује са глобалним циљевима одрживости. Како истраживачи континуирано побољшавају композиције електродапојачајући стабилност и густину енергијеоптимизују формулације електролита како би повећали живот циклуса и безбедност, и унапредили производне процесе на великом нивоу како би смањили трошкове производње, натријум-јонска технологија постепено превази Коришћењем једноставног, али моћног кретања натријумских јона, не само да ефикасно и приступачно чувамо електричну енергију, већ стварамо и приступачнију, отпорнију и одрживу енергијску будућност. Он премочава јаз између технолошке иновације и стварне примене, нудећи одржив пут за смањење емисије угљен-диоксида и изградњу зеленијег глобалног енергетског екосистема.