Alors que la demande mondiale de solutions de stockage d'énergie durables et rentables s'intensifie, les batteries sodium-ion (Na-ion) émergent comme une alternative intéressante aux technologies traditionnelles de batteries lithium-ion (Li-ion). Grâce à des matières premières abondantes, un impact environnemental réduit et des performances électrochimiques prometteuses, les batteries Na-ion gagnent rapidement en popularité dans des applications allant du stockage d'énergie à grande échelle jusqu'aux véhicules électriques et aux appareils électroniques grand public. Au cœur de cette innovation se trouve un processus électrochimique fondamental : le déplacement réversible des ions sodium entre la cathode et l'anode pendant les cycles de charge et de décharge. Dans cet article, nous explorons les mécanismes complexes qui régissent les cycles de charge et de décharge des batteries sodium-ion, éclairant ainsi la raison pour laquelle cette technologie est prête à redéfinir l'avenir du stockage de l'énergie.
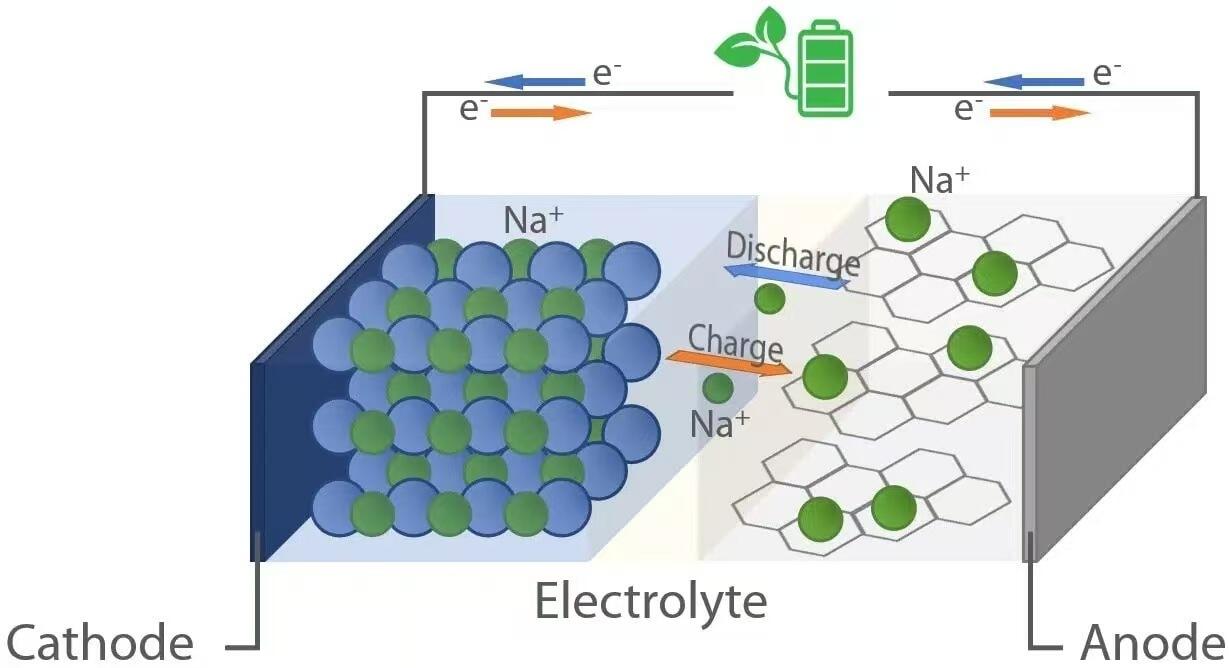
Comme leurs homologues lithium-ion, les batteries sodium-ion fonctionnent selon le principe d'une électrochimie de type « rocking-chair ». Pendant la décharge — lorsque la batterie alimente un dispositif — des ions sodium (Na⁺) migrent de l'anode (électrode négative) à travers l'électrolyte vers la cathode (électrode positive). Simultanément, les électrons circulent à travers le circuit externe, fournissant de l'énergie électrique à la charge connectée. Inversement, pendant la charge, une source d'alimentation externe force les ions sodium à revenir de la cathode vers l'anode, stockant ainsi de l'énergie pour une utilisation ultérieure. Ce va-et-vient réversible des ions est permis par des matériaux hôtes dans les deux électrodes, capables d'intercaler (insérer) et de désintercaler (extraire) réversiblement les ions sodium sans dégradation structurelle significative.
Lorsqu'une batterie au sodium-ion se décharge, une oxydation se produit à l'anode. Les matériaux d'anode courants incluent le carbone dur, qui possède une structure désordonnée avec des nanopores capables d'accueillir les ions Na⁺. Alors que la batterie fournit de l'énergie, les atomes de sodium dans l'anode libèrent des électrons (e⁻) et deviennent des ions Na⁺ :
Anode (Oxydation) :
Na → Na⁺ + e⁻
Ces électrons circulent à travers le circuit externe pour alimenter les appareils, tandis que les ions Na⁺ migrent à travers l'électrolyte liquide ou solide en direction de la cathode. À la cathode—généralement composée d'oxydes de métaux de transition en couches (par exemple, NaₓMO₂, où M = Mn, Fe, Ni, etc.), de composés polyanioniques ou d'analogues du bleu de Prusse—une réduction a lieu lorsque les ions Na⁺ et les électrons entrants sont intégrés dans le réseau cristallin :
Cathode (Réduction) :
Na⁺ + e⁻ + Hôte → Na–Hôte
Cette insertion stabilise la structure de la cathode et complète le circuit électrochimique. La tension générée pendant la décharge dépend de la différence de potentiel électrochimique entre les matériaux de l'anode et de la cathode, généralement comprise entre 2,5 et 3,7 volts pour les cellules Na-ion commerciales.
Pendant la charge, une tension externe supérieure à la tension en circuit ouvert de la cellule est appliquée, inversant ainsi les réactions électrochimiques. Les ions sodium sont extraits de la cathode par oxydation :
Cathode (Oxydation) :
Na–Hôte → Na⁺ + e⁻ + Hôte
Les ions Na⁺ libérés traversent l'électrolyte pour retourner à l'anode, tandis que les électrons reviennent via la source d'alimentation externe. À l'anode, une réduction a lieu lorsque les ions Na⁺ se combinent avec les électrons et se réinsèrent dans la matrice de carbone :
Anode (Réduction) :
Na⁺ + e⁻ → Na (intercalé)
Ce processus restaure l'énergie stockée dans la batterie, la préparant pour le prochain cycle de décharge. Un transfert de charge efficace, des réactions secondaires minimales et une stabilité structurelle des matériaux d'électrode sont essentiels pour atteindre une longue durée de vie en cycles et une haute efficacité coulombique—des indicateurs clés de la viabilité commerciale.
L'électrolyte—généralement un sel de sodium (par exemple NaClO₄ ou NaPF₆) dissous dans des solvants carbonatés organiques—joue un rôle crucial en permettant un transport rapide des ions tout en maintenant une stabilité électrochimique. Pendant les premiers cycles de charge, une interphase solide-électrolyte (SEI) se forme à la surface de l'anode. Cette couche de passivation empêche une décomposition supplémentaire de l'électrolyte tout en permettant aux ions Na⁺ de passer—un équilibre délicat essentiel pour la sécurité et la longévité.
L'abondance naturelle du sodium (plus de 1 000 fois supérieure à celle du lithium dans la croûte terrestre) se traduit par des coûts matériels plus faibles et une réduction des risques d'approvisionnement géopolitiques. De plus, l'aluminium peut être utilisé comme collecteur de courant pour l'anode dans les batteries Na-ion (contrairement aux batteries Li-ion, qui nécessitent du cuivre), réduisant ainsi davantage les coûts et le poids. Toutefois, les ions sodium sont plus gros et plus lourds que les ions lithium, ce qui entraîne une densité énergétique légèrement inférieure et des cinétiques de diffusion plus lentes. Les recherches en cours visent à développer des architectures d'électrodes avancées, des matériaux nanostructurés et des électrolytes solides afin de surmonter ces limitations.
Les mécanismes de charge et de décharge des batteries sodium-ion illustrent la synergie élégante entre science des matériaux et électrochimie, posant ainsi les bases solides d'un stockage d'énergie de nouvelle génération. Contrairement aux batteries lithium-ion, leur utilisation du sodium, abondant et peu coûteux, réduit non seulement les risques liés à la chaîne d'approvisionnement, mais s'inscrit également dans les objectifs mondiaux de durabilité. Alors que les chercheurs affinent continuellement les compositions des électrodes — en améliorant la stabilité et la densité énergétique — optimisent les formulations d'électrolytes pour accroître la durée de vie en cycles et la sécurité, et font progresser les procédés de fabrication à grande échelle afin de réduire les coûts de production, la technologie sodium-ion surmonte progressivement les obstacles techniques restants. Ce progrès place les batteries Na-ion en position de jouer un rôle transformateur dans la décarbonation des systèmes énergétiques mondiaux, allant du stockage à l'échelle du réseau, soutenant l'intégration des énergies renouvelables, jusqu'à l'alimentation portable et la mobilité électrique à basse vitesse. En exploitant le mouvement simple mais puissant des ions sodium, nous ne faisons pas seulement stocker l'électricité de manière efficace et abordable — nous façonnons un avenir énergétique plus accessible, plus résilient et plus durable. Elle comble l'écart entre innovation technologique et application concrète, offrant une voie viable pour réduire les émissions de carbone et construire un écosystème énergétique mondial plus vert.
 Actualités à la Une
Actualités à la Une