जैसे-जैसे विश्व स्तर पर स्थायी और लागत प्रभावी ऊर्जा भंडारण समाधानों की मांग बढ़ रही है, सोडियम-आयन (Na-आयन) बैटरियाँ पारंपरिक लिथियम-आयन (Li-आयन) तकनीकों के एक आकर्षक विकल्प के रूप में उभर रही हैं। प्रचुर मात्रा में कच्चे माल, कम पर्यावरणीय प्रभाव और आशाजनक इलेक्ट्रोकेमिकल प्रदर्शन के साथ, Na-आयन बैटरियाँ ग्रिड-स्तर के ऊर्जा भंडारण से लेकर इलेक्ट्रिक वाहनों और उपभोक्ता इलेक्ट्रॉनिक्स तक के अनुप्रयोगों में तेजी से लोकप्रियता प्राप्त कर रही हैं। इस नवाचार के केंद्र में एक मौलिक इलेक्ट्रोकेमिकल प्रक्रिया निहित है: चार्जिंग और डिस्चार्जिंग के दौरान कैथोड और एनोड के बीच सोडियम आयनों की उत्क्रमणीय गति। इस लेख में, हम सोडियम-आयन बैटरियों के चार्ज और डिस्चार्ज चक्रों को नियंत्रित करने वाली जटिल यांत्रिकी का पता लगाते हैं, जो इस तकनीक को ऊर्जा भंडारण के भविष्य को पुनर्आकार देने के लिए तैयार करती है, इस पर प्रकाश डालते हैं।
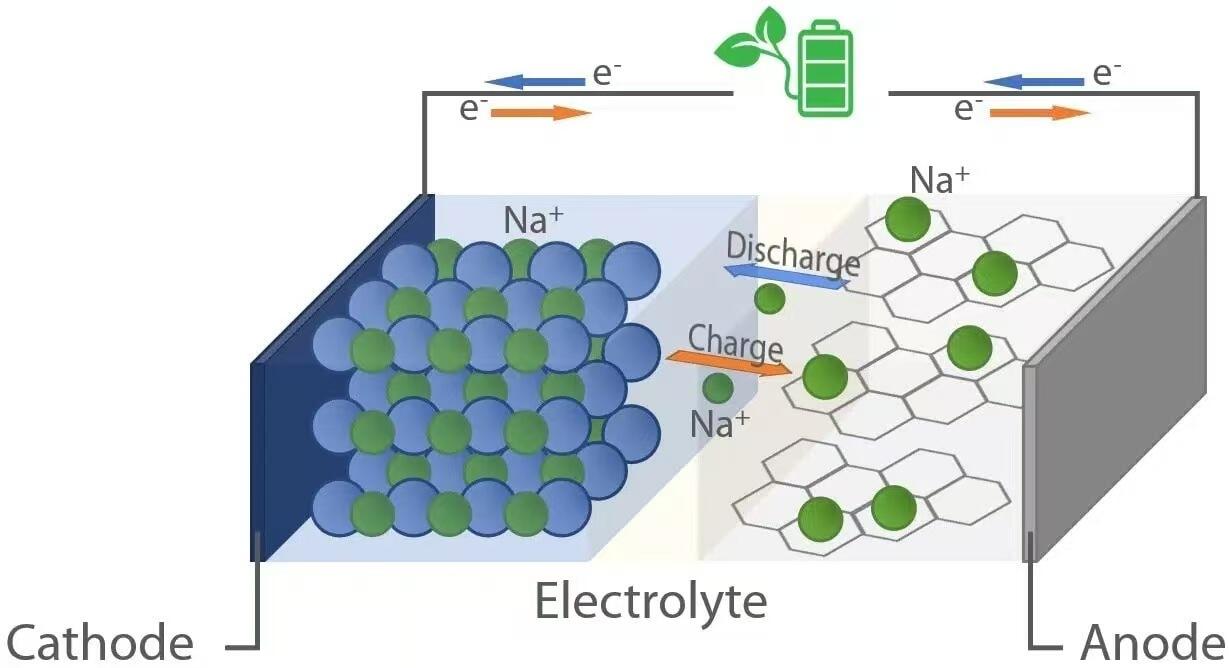
लिथियम-आयन के समान, सोडियम-आयन बैटरियाँ "रॉकिंग-चेयर" इलेक्ट्रोकैमिस्ट्री के सिद्धांत पर काम करती हैं। डिस्चार्ज के दौरान—जब बैटरी किसी उपकरण को ऊर्जा प्रदान करती है—सोडियम आयन (Na⁺) एनोड (नकारात्मक इलेक्ट्रोड) से इलेक्ट्रोलाइट के माध्यम से कैथोड (धनात्मक इलेक्ट्रोड) की ओर प्रवाहित होते हैं। इसी बीच, इलेक्ट्रॉन बाह्य परिपथ के माध्यम से प्रवाहित होकर जुड़े लोड को विद्युत ऊर्जा प्रदान करते हैं। इसके विपरीत, चार्जिंग के दौरान, बाह्य बिजली स्रोत सोडियम आयनों को कैथोड से एनोड की ओर वापस धकेलता है, जिससे भविष्य में उपयोग के लिए ऊर्जा संग्रहित होती है। यह उत्क्रमणीय आयन शटलिंग दोनों इलेक्ट्रोड में मौजूद होस्ट सामग्री द्वारा संभव होता है, जो संरचनात्मक क्षरण के बिना सोडियम आयनों को उत्क्रमणीय रूप से इंटरकैलेट (अंतःस्थापित करना) और डीइंटरकैलेट (निकालना) कर सकते हैं।
जब एक सोडियम-आयन बैटरी डिस्चार्ज होती है, तो एनोड पर ऑक्सीकरण होता है। सामान्य एनोड सामग्री में कठोर कार्बन शामिल है, जिसमें नैनोपोर्स के साथ एक अव्यवस्थित संरचना होती है जो Na⁺ आयनों को समायोजित करने में सक्षम होती है। जब बैटरी पावर प्रदान करती है, तो एनोड के भीतर सोडियम परमाणु इलेक्ट्रॉन (e⁻) मुक्त करते हैं और Na⁺ आयन बन जाते हैं:
एनोड (ऑक्सीकरण):
Na → Na⁺ + e⁻
ये इलेक्ट्रॉन उपकरणों को शक्ति प्रदान करने के लिए बाह्य सर्किट के माध्यम से यात्रा करते हैं, जबकि Na⁺ आयन तरल या ठोस इलेक्ट्रोलाइट के माध्यम से कैथोड की ओर बढ़ते हैं। कैथोड पर—जो आमतौर पर परतदार ट्रांजिशन धातु ऑक्साइड्स (उदाहरण के लिए, NaₓMO₂, जहाँ M = Mn, Fe, Ni, आदि), पॉलीएनायोनिक यौगिकों, या प्रूसियन ब्लू एनालॉग्स से बना होता है—अपचयन होता है क्योंकि Na⁺ आयन और आने वाले इलेक्ट्रॉन क्रिस्टल लैटिस में शामिल हो जाते हैं:
कैथोड (अपचयन):
Na⁺ + e⁻ + होस्ट → Na–होस्ट
यह प्रविष्टि कैथोड संरचना को स्थिर करती है और इलेक्ट्रोकेमिकल सर्किट को पूरा करती है। डिस्चार्ज के दौरान उत्पन्न वोल्टेज एनोड और कैथोड सामग्री के बीच इलेक्ट्रोकेमिकल क्षमता के अंतर पर निर्भर करता है, जो आमतौर पर व्यावसायिक Na-आयन सेल के लिए 2.5 से 3.7 वोल्ट के बीच होता है।
चार्जिंग के दौरान, सेल के ओपन-सर्किट वोल्टेज से अधिक एक बाह्य वोल्टेज लागू किया जाता है, जिससे इलेक्ट्रोकेमिकल अभिक्रियाएँ उलट जाती हैं। सोडियम आयन कैथोड से ऑक्सीकरण के माध्यम से निकाले जाते हैं:
कैथोड (ऑक्सीकरण):
Na–Host → Na⁺ + e⁻ + Host
मुक्त किए गए Na⁺ आयन इलेक्ट्रोलाइट के माध्यम से एनोड की ओर जाते हैं, जबकि इलेक्ट्रॉन बाह्य बिजली स्रोत के माध्यम से वापस आते हैं। एनोड पर, Na⁺ आयन इलेक्ट्रॉनों के साथ संयोजित होकर कार्बन मैट्रिक्स में पुनः अंतर्वेशित होने के कारण अपचयन होता है:
एनोड (अपचयन):
Na⁺ + e⁻ → Na (अंतर्वेशित)
यह प्रक्रिया बैटरी की संग्रहीत ऊर्जा को पुनर्स्थापित करती है, जो अगले निर्वहन चक्र के लिए इसे तैयार करती है। लंबे चक्र जीवन और उच्च कूलम्बिक दक्षता—वाणिज्यिक व्यवहार्यता के लिए महत्वपूर्ण मापदंडों को प्राप्त करने के लिए आवेश स्थानांतरण की दक्षता, न्यूनतम पार्श्विक अभिक्रियाएँ और इलेक्ट्रोड सामग्री की संरचनात्मक स्थिरता महत्वपूर्ण हैं।
इलेक्ट्रोलाइट—आमतौर पर एक कार्बनिक कार्बोनेट विलायक में घुला सोडियम लवण (उदाहरण के लिए, NaClO₄ या NaPF₆)—तेज़ आयन परिवहन को सक्षम करने और इलेक्ट्रोकेमिकल स्थिरता बनाए रखने में एक महत्वपूर्ण भूमिका निभाता है। प्रारंभिक आवेश चक्र के दौरान, एनोड की सतह पर एक ठोस-इलेक्ट्रोलाइट इंटरफ़ेस (SEI) बनता है। यह निष्क्रियता परत इलेक्ट्रोलाइट के आगे विघटन को रोकती है, जबकि Na⁺ आयनों को पार करने की अनुमति देती है—सुरक्षा और लंबे जीवन के लिए आवश्यक एक सूक्ष्म संतुलन।
सोडियम की प्राकृतिक प्रचुरता (पृथ्वी के भूपटल में लिथियम की तुलना में 1,000 गुना अधिक) से सामग्री की लागत में कमी आती है और भू-राजनीतिक आपूर्ति जोखिम कम होता है। इसके अतिरिक्त, Na-आयन बैटरियों में एनोड के लिए धारा संग्राहक के रूप में एल्युमीनियम का उपयोग किया जा सकता है (Li-आयन के विपरीत, जिसमें तांबे की आवश्यकता होती है), जिससे लागत और वजन दोनों में और कमी आती है। हालांकि, सोडियम आयन लिथियम आयन की तुलना में बड़े और भारी होते हैं, जिसके परिणामस्वरूप थोड़ी कम ऊर्जा घनत्व और धीमी विसरण गतिशीलता होती है। इन सीमाओं पर काबू पाने के लिए उन्नत इलेक्ट्रोड वास्तुकला, नैनोसंरचित सामग्री और ठोस-अवस्था इलेक्ट्रोलाइट विकसित करने पर निरंतर अनुसंधान चल रहा है।
सोडियम-आयन बैटरियों के आवेशन और निरावेशन तंत्र पदार्थ विज्ञान और विद्युत रसायन विज्ञान के बीच सुगठित सहयोग का उदाहरण प्रस्तुत करते हैं, जो अगली पीढ़ी के ऊर्जा भंडारण के लिए एक मजबूत आधार तैयार करता है। लिथियम-आयन बैटरियों के विपरीत, प्रचुर मात्रा में उपलब्ध और कम लागत वाले सोडियम पर निर्भरता केवल आपूर्ति श्रृंखला के जोखिम को कम करती है, बल्कि वैश्विक स्थिरता लक्ष्यों के साथ भी संरेखित होती है। जैसे-जैसे शोधकर्ता इलेक्ट्रोड संरचनाओं में स्थिरता और ऊर्जा घनत्व में सुधार करते हुए सुधार कर रहे हैं, चक्र जीवन और सुरक्षा में वृद्धि के लिए इलेक्ट्रोलाइट सूत्रों का अनुकूलन कर रहे हैं, और उत्पादन लागत को कम करने के लिए बड़े पैमाने पर उत्पादन प्रक्रियाओं में सुधार कर रहे हैं, वैसे-वैसे सोडियम-आयन प्रौद्योगिकी शेष तकनीकी बाधाओं पर लगातार काबू पा रही है। यह प्रगति Na-आयन बैटरियों को विश्व स्तर पर ऊर्जा प्रणालियों के डीकार्बोनीकरण में एक रूपांतरकारी भूमिका निभाने की स्थिति में ला रही है—अक्षय ऊर्जा एकीकरण का समर्थन करने वाले ग्रिड-स्केल भंडारण से लेकर पोर्टेबल पावर और निम्न-गति विद्युत गतिशीलता तक। सोडियम आयनों की सरल लेकिन शक्तिशाली गति का उपयोग करके, हम केवल बिजली को कुशलता और कम लागत पर संग्रहित कर ही नहीं रहे हैं—बल्कि हम एक अधिक सुलभ, लचीले और स्थायी ऊर्जा भविष्य का निर्माण कर रहे हैं। यह तकनीकी नवाचार और वास्तविक दुनिया के अनुप्रयोग के बीच की खाई को पाटता है, कार्बन उत्सर्जन को कम करने और एक हरित वैश्विक ऊर्जा पारिस्थितिकी तंत्र बनाने के लिए एक व्यवहार्य मार्ग प्रदान करता है।