A medida que aumenta la demanda global de soluciones sostenibles y rentables de almacenamiento de energía, las baterías de sodio-ión (Na-ión) han surgido como una alternativa atractiva frente a las tecnologías tradicionales de iones de litio (Li-ión). Con materias primas abundantes, menor impacto ambiental y un rendimiento electroquímico prometedor, las baterías Na-ión están ganando rápidamente terreno en aplicaciones que van desde el almacenamiento de energía a escala de red hasta vehículos eléctricos y electrónica de consumo. En el centro de esta innovación subyace un proceso electroquímico fundamental: el movimiento reversible de iones de sodio entre el cátodo y el ánodo durante los ciclos de carga y descarga. En este artículo, exploramos los mecanismos complejos que rigen los ciclos de carga y descarga de las baterías de sodio-ión, arrojando luz sobre por qué esta tecnología está preparada para transformar el futuro del almacenamiento de energía.
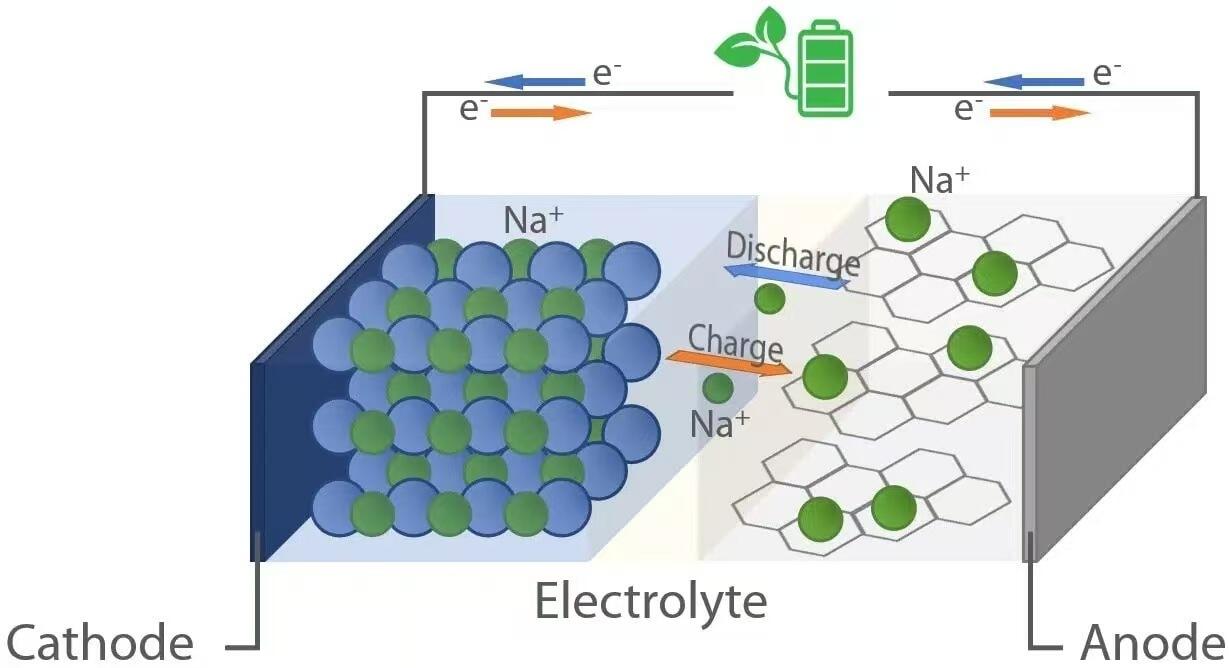
Al igual que sus contrapartes de iones de litio, las baterías de iones de sodio funcionan según el principio de la electroquímica tipo "rocking-chair". Durante la descarga—cuando la batería alimenta un dispositivo—los iones de sodio (Na⁺) migran desde el ánodo (electrodo negativo) a través del electrolito hacia el cátodo (electrodo positivo). Simultáneamente, los electrones fluyen a través del circuito externo, entregando energía eléctrica a la carga conectada. Por el contrario, durante la carga, una fuente de alimentación externa impulsa a los iones de sodio desde el cátodo de regreso al ánodo, almacenando energía para su uso futuro. Este transporte reversible de iones se facilita mediante materiales huésped en ambos electrodos que pueden intercalar (insertar) y desintercalar (extraer) iones de sodio sin una degradación estructural significativa.
Cuando una batería de iones de sodio se descarga, ocurre oxidación en el ánodo. Los materiales comunes para el ánodo incluyen carbono duro, que posee una estructura desordenada con nanoporos capaces de alojar iones Na⁺. A medida que la batería suministra energía, los átomos de sodio dentro del ánodo liberan electrones (e⁻) y se convierten en iones Na⁺:
Ánodo (Oxidación):
Na → Na⁺ + e⁻
Estos electrones viajan a través del circuito externo para alimentar dispositivos, mientras que los iones Na⁺ se mueven a través del electrolito líquido o sólido hacia el cátodo. En el cátodo—típicamente compuesto por óxidos de metales de transición estratificados (por ejemplo, NaₓMO₂, donde M = Mn, Fe, Ni, etc.), compuestos polianiónicos o análogos del azul de Prusia—ocurre la reducción cuando los iones Na⁺ y los electrones entrantes se incorporan a la red cristalina:
Cátodo (Reducción):
Na⁺ + e⁻ + Huésped → Na–Huésped
Esta inserción estabiliza la estructura del cátodo y completa el circuito electroquímico. El voltaje generado durante la descarga depende de la diferencia en potencial electroquímico entre los materiales del ánodo y el cátodo, que normalmente oscila entre 2,5 y 3,7 voltios para celdas comerciales de iones de sodio.
Durante la carga, se aplica un voltaje externo mayor que el voltaje en circuito abierto de la celda, invirtiendo así las reacciones electroquímicas. Los iones de sodio se extraen del cátodo mediante oxidación:
Cátodo (Oxidación):
Na–Host → Na⁺ + e⁻ + Host
Los iones Na⁺ liberados atraviesan el electrolito de regreso al ánodo, mientras que los electrones regresan a través de la fuente de alimentación externa. En el ánodo, ocurre una reducción cuando los iones Na⁺ se combinan con electrones y se reintercalan en la matriz de carbono:
Ánodo (Reducción):
Na⁺ + e⁻ → Na (intercalado)
Este proceso restaura la energía almacenada en la batería, preparándola para el siguiente ciclo de descarga. La transferencia eficiente de carga, las reacciones secundarias mínimas y la estabilidad estructural de los materiales del electrodo son fundamentales para lograr una larga vida útil y una alta eficiencia coulómbica, métricas clave para la viabilidad comercial.
El electrolito—generalmente una sal de sodio (por ejemplo, NaClO₄ o NaPF₆) disuelta en solventes de carbonato orgánico—desempeña un papel fundamental al permitir un transporte rápido de iones manteniendo al mismo tiempo la estabilidad electroquímica. Durante los primeros ciclos de carga, se forma una interfase sólida-electrolito (SEI) sobre la superficie del ánodo. Esta capa de pasivación evita la descomposición adicional del electrolito mientras permite el paso de iones Na⁺, un equilibrio delicado esencial para la seguridad y la longevidad.
La abundancia natural del sodio (más de 1.000 veces más presente que el litio en la corteza terrestre) se traduce en menores costos de materiales y una reducción de los riesgos geopolíticos de suministro. Además, el aluminio puede utilizarse como colector de corriente para el ánodo en las baterías de sodio (a diferencia de las de litio, que requieren cobre), lo que reduce aún más los costos y el peso. Sin embargo, los iones de sodio son más grandes y pesados que los iones de litio, lo que resulta en una densidad energética ligeramente menor y una cinética de difusión más lenta. La investigación actual se centra en desarrollar arquitecturas avanzadas de electrodos, materiales nanoestructurados y electrolitos de estado sólido para superar estas limitaciones.
Los mecanismos de carga y descarga de las baterías de iones de sodio ejemplifican la elegante sinergia entre la ciencia de materiales y la electroquímica, sentando una base sólida para el almacenamiento de energía de próxima generación. A diferencia de sus homólogas de iones de litio, su dependencia del sodio, abundante y de bajo costo, no solo mitiga los riesgos en la cadena de suministro, sino que también se alinea con los objetivos globales de sostenibilidad. A medida que los investigadores perfeccionan continuamente las composiciones de los electrodos —mejorando la estabilidad y la densidad energética—, optimizan las formulaciones de los electrolitos para aumentar la vida útil y la seguridad, y avanzan en procesos de fabricación a gran escala para reducir los costos de producción, la tecnología de iones de sodio está superando progresivamente las barreras técnicas restantes. Este avance posiciona a las baterías Na-ion para desempeñar un papel transformador en la descarbonización de los sistemas energéticos mundiales, desde el almacenamiento a escala de red que apoya la integración de energías renovables hasta la energía portátil y la movilidad eléctrica de baja velocidad. Al aprovechar el movimiento simple pero poderoso de los iones de sodio, no solo estamos almacenando electricidad de forma eficiente y asequible, sino que también estamos forjando un futuro energético más accesible, resistente y sostenible. Esta tecnología cierra la brecha entre la innovación tecnológica y la aplicación práctica, ofreciendo un camino viable para reducir las emisiones de carbono y construir un ecosistema energético global más verde.
 Noticias Calientes
Noticias Calientes